
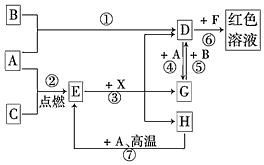
 A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B为液体,C为气体.D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体.它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去).
A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B为液体,C为气体.D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体.它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去).分析 A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B为液体,C为气体,则单质A应为金属,A和H高温反应生成E为黑色固体,E黑色固体和X反应生成D、G、H,其中DG之间可以实现相互转化,说明A为变价金属Fe,和C在点燃条件下生成黑色固体E为Fe3O4,C为O2,依据D+A=G说明D为含三价铁离子的化合物,F为含硫氰酸根离子的化合物,G为含Fe2+离子的化合物,单质B常温下是液态,能与Fe反应,则B为Br2,D为FeBr3,D与F得到红色溶液,则F为KSCN,由D与G之间的相互转化,可知G为FeBr2,Fe与气体C反应得到E,E与X反应得到D、G、H,H在常温下为液体,X是一种无氧强酸,可推知X为HBr,H为H2O,据此解答.
解答 解:(1)由上述分析可知,A为Fe,D为FeBr3,E为Fe3O4,X为HBr,
故答案为:Fe;FeBr3;Fe3O4;HBr;
(2)在反应①~⑦中,①为铁和溴发生的氧化还原反应,②为铁和氧气发生的氧化还原反应,③为四氧化三铁和HBr发生的复分解反应,不是氧化还原反应,④为溴化铁和铁发生的氧化还原反应,⑤为溴化亚铁和溴发生的氧化还原反应,⑥是溴化铁和硫氰酸盐发生的络合反应,不是氧化还原反应,
故答案为:③⑥;
(3)反应⑥是氯化铁和硫氰酸盐发生的复分解反应,反应的离子方程式为:Fe3++3SCN-=Fe(SCN)3,故答案为:Fe3++3SCN-=Fe(SCN)3;
(4)反应⑦是铁在水蒸气中发生的反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;该反应中符合氧化还原反应的电子守恒,氢元素化合价从+1价变化为0价,4H2O反应转移电子为 8mol,铁元素从0价变化为+$\frac{8}{3}$价,每消耗 0.3mol的A(Fe),可转移电子0.8mol,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;0.8.
(5)D为FeBr3,D的溶液与小苏打溶液反应的离子方程式为Fe3++3HCO3-=Fe(OH)3↓+3CO2↑,D的溶液中通人少量SO2反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,
故答案为:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑;2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
点评 本题考查无机物推断,涉及Fe、Br元素化合物的性质与转化,需要熟练掌握元素化合物知识,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 使石蕊变红色的溶液:Fe2+、K+、SO42-、NO3- | |
| B. | 使酚酞变红色的溶液:Na+、Mg2+、Cl-、Al3+ | |
| C. | 0.1mol•L-1Na2SO3溶液:K+、SO42-、ClO- | |
| D. | 0.1mol•L-1NaAlO2溶液:Na+、Cl-、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁、纯碱、冰水混合物 | B. | 氢气、陶瓷、漂白粉 | ||
| C. | 液氧、烧碱、碘酒 | D. | 金刚石、二氧化碳、漂粉精 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 阳离子 | K+、Ag+、Mg2+、Ba2+ |
| 阴离子 | NO3、CO32-、SO42-、SiO32- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀HCl | 产生白色沉淀并放出0.56L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
| Ⅲ | 在Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在18g${\;}_{\;}^{18}$O2中含有NA个氧分子 | |
| B. | 标准状况下,22.4L空气含有NA个单质分子 | |
| C. | 1 molCI2参加反应转移电子数可能为1NA | |
| D. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食醋 | B. | 酒精 | C. | 食盐 | D. | 葡萄糖 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com