
钢铁发生吸氧腐蚀时,正极上发生的电极反应是
A.2H++2e-=H2 B.Fe2++2e-=Fe
C.2H2O+O2+4e-=4OH- D.Fe3++e-=Fe2+
科目:高中化学 来源:2014-2015学年湖南省高二下期中理科化学试卷(解析版) 题型:选择题
使1mol乙烯与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生取代反应,假设各步反应有机物均完全反应且不考虑副反应,则两个过程中消耗的氯气的总的物质的量是( )
A.3mol B.4mol C.5mol D.6mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省枣阳市高二下期中化学试卷(解析版) 题型:填空题
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
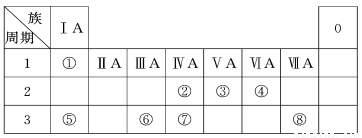
(1)地壳中含量居于第二位的元素在周期表中的位置是________________。
(2)②、⑦的最高价含氧酸的酸性是由强到弱的,用原子结构解释原因:__________,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的离子化合物,写出其中一种化合物的电子式_______________。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,下列物质不能做该反应催化剂的是(填序号)________。
a.MnO2 b. CuSO4 c.Na2SO3 d.FeCl3
(5)W与④是相邻的同主族元素。在下表中列出H2WO3的各种不同化学性质,举例并写出相应的化学方程式。
编号 | 性质 | 化学方程式 |
示例 | 氧化性 | H2WO3+3H3PO3===3H3PO4+H2W↑ |
1 | ||
2 |
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
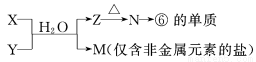
X溶液与Y溶液反应的离子方程式______________,
N→⑥的单质的化学方程式为____________,
M溶液中离子浓度由大到小的排列顺序是______________ ,
M中阳离子的鉴定方法 __________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省枣阳市高二下期中化学试卷(解析版) 题型:选择题
某化合物由两种单质直接反应生成,将其加入 溶液中同时有气体和沉淀产生。下列化合物中符合上述条件的是:
溶液中同时有气体和沉淀产生。下列化合物中符合上述条件的是:
A.AlCl3 B.Na2O C.FeCl2 D.SiO2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省枣阳市高二下期中化学试卷(解析版) 题型:选择题
下列关于有机物的叙述不正确的是
A.甲烷、乙烯和苯都可通过石油分馏得到
B.油脂在碱的作用下可发生水解,工业上利用该反应生产肥皂
C.用灼烧并闻气味的方法可以区分纯棉织物和纯毛织物
D.钠跟水反应比跟乙醇反应剧烈
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省宜昌市高一下期中化学A卷(解析版) 题型:填空题
下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白(涉及表中元素一律用对应化学符号表示):
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:________(填具体元素符号,下同),原子结构示意图为________。元素⑩名称为________在周期表中的位置________。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是________,碱性最强的化合物的电子式是:________。
(3)用电子式表示元素④与⑥的化合物的形成过程:________________,该化合物属于________(填“共价”或“离子”)化合物。
(4)表示①与⑦的化合物的电子式________,该化合物是由________(填”极性”、“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是______________。
(6)元素③的氢化物的结构式为________;该氢化物常温下和元素⑦的单质反应的化学方程式为_________ _____。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省宜昌市高一下期中化学A卷(解析版) 题型:选择题
( )下列各组气体,在通常情况下既能用浓硫酸又能用碱石灰干燥的有
A.SO2、O2、N2 B.HCl、Cl2、CO2
C.CH4、H2、CO D.SO2、Cl2、O2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省宜昌市高二下期中化学试卷(解析版) 题型:填空题
Na2CO3俗称纯碱、苏打,NaHCO3俗称小苏打,两者在日常生活和工业生产中都有着广泛的应用。某化学兴趣小组设计了如下实验来探究两者的某些性质。请你根据所学知识帮他们完成有关的设计和实验。
(1)甲同学测定两者的酸碱性:各取一定量的固体溶于水,配成相同浓度的溶液,测定其pH值,测定结果为Na2CO3、NaHCO3的pH分别为a和b(a、b均大于7),则a b(填“大于”“等于”或“小于”)。
(2)有关①100mL0.1 mol·L-1NaHCO3、②100mL0.1 mol·L-1Na2CO3,两种溶液的叙述不正确是
A.NaHCO3溶液中:c (H+)+c (Na+)= c (HCO)+2c(CO)+c(OH-)
B.Na2CO3溶液中:2c (Na+)= c (HCO)+c(CO)+ c(H2CO3)
C.①溶液中:c(CO)>c(H2CO3)
D.②溶液中:c(HCO)>c(H2CO3)
(3)乙同学取一定量的碳酸钠溶液于试管中,滴加2~3滴酚酞试液,发现溶液变红,继续滴加BaCl2溶液,预计可观察到的现象是 ,请你结合必要的离子方程式,应用平衡的观点解释有关现象的产生: 。
(4)丙同学往10mL0.10 mol·L-1的Na2CO3溶液中逐滴滴加0.10 mol·L-1的HCl,当溶液中的:c(Na+)=c(Cl-)+c(HCO)+2c(CO),此时溶液呈 (填“酸性”、“中性”或“碱性”),所用HCl的体积
10mL。(填“大于”“等于”或“小于”)
(5)已知:Ksp(CaCO3)=4.96×10-9,不考虑其它因素影响,现将0.40 mol·L-1的Na2CO3溶液和0.20 mol·L-1的CaCl2溶液等体积混合,则混合后溶液中Ca2+浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省襄阳市高一下期中化学试卷(解析版) 题型:选择题
下列属于吸热反应的是( )
①液态水汽化 ②将胆矾加热变为白色粉末 ③苛性钠溶于水
④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰 ⑥干冰升华.
A.①④ B.②④ C.③⑤ D.④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com