
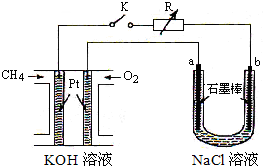
 ����Ч�ļ���ȼ�ϵ�ز��ò�Ϊ�缫���ϣ����缫�Ϸֱ�ͨ��CH4��O2�������ΪKOH��Һ��ij�о�С�齫����ȼ�ϵ����Ϊ��Դ�������Ȼ�þ��Һ���ʵ�飬���װ����ͼ��ʾ��
����Ч�ļ���ȼ�ϵ�ز��ò�Ϊ�缫���ϣ����缫�Ϸֱ�ͨ��CH4��O2�������ΪKOH��Һ��ij�о�С�齫����ȼ�ϵ����Ϊ��Դ�������Ȼ�þ��Һ���ʵ�飬���װ����ͼ��ʾ������ ��1������ȼ�ϵ���У������ϼ���ʧ���ӷ���������Ӧ����ع����ڼ䣬���������ƶ���
��2���պ�K���غ�a��������b�������������������ӷŵ磬��ʪ��ĵ��۵⻯����ֽ���������������������ӷŵ磬ͬʱ��Һ�������������ƣ�
��3������ת�Ƶ����غ��ϵ缫��Ӧʽ�����㣻
��4��ȼ������1mol��ȼ����ȫȼ�������ȶ�������ʱ�ų�����������֪����C��ʯī��+O2��g��=CO2��g����H1=-393.5kJ/mol��2H2��g��+O2��g��=2H2O��l����H2=-571.6kJ/mol�Լ��ۼ����ȼ�����Ȼ�ѧ����ʽ�����ݸ�˹���ɼ��㼴�ɣ�
��� �⣺��1������ȼ�ϵ���У������ϼ���ʧ���ӷ���������Ӧ���缫��ӦʽΪ��CH4+10OH--8e-�TCO32-+7H2O����ع����ڼ䣬���������ƶ���OH-Ӧ���ƶ�
���ʴ�Ϊ��CH4+10OH--8e-=CO32-+7H2O������
��2���պ�K���غ�a��������b��������a���������ӷŵ������������缫����ʽΪ2Cl--2e-=Cl2��ʪ��ĵ��۵⻯����ֽ�������������ӷŵ磬����������ͬʱ��Һ�������������ƣ����Ե�ط�Ӧ�����ӷ���ʽΪ2Cl-+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2OH-+H2��+Cl2�����ʴ�Ϊ��ʪ��ĵ��۵⻯����ֽ��H2��2Cl-+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2OH-+H2��+Cl2����
��3��������ͨ����Ϊ 1.12L����״���������������ʵ���Ϊ$\frac{1.12L}{22.4L/mol}$=0.05mol����CH4+10OH--8e-�TCO32-+7H2O����ת�Ƶ���Ϊ0.4mol��
����ת�Ƶ����غ�����������=0.4mol��$\frac{1}{2}$��22.4L/mol=4.48L��
�ʴ�Ϊ��0.4mol��4.48��
��4����ͬ�����£�0.25molCH4��ȫȼ������CO2��H2Oʱ���ų�222.5kJ��������1mol������ȫȼ������Һ̬ˮ���Ȼ�ѧ����ʽΪ��CH4��g��+2O2 ��g��=CO2��g��+2H2O��1������H=-890kJ/mol����֪����C��ʯī��+O2��g��=CO2��g����H1=-393.5kJ/mol����2H2��g��+O2��g��=2H2O��l����H2=-571.6kJ/mol����CH4��g��+2O2��g��=CO2��g��+2H2O��l����H=-890kJ/mol�����ݸ�˹���ɣ�C��ʯī����H2��g����Ӧ����1molCH4��g���ķ�Ӧ���Ը��ݢ�+��-�۵õ������Է�Ӧ���ʱ�=��-393.5kJ/mol��+��-571.6kJ/mol��-��-890kJ/mol ��=-75.1kJ/mol��
�ʴ�Ϊ��CH4��g��+2O2��g��=CO2��g��+2H2O��l����H=-890kJ/mol��-75.1kJ/mol��
���� �����漰ԭ��غ͵��صĹ���ԭ���Լ��Ȼ�ѧ����ʽ����д��˹���ɵ�Ӧ��֪ʶ�������ۺ�֪ʶ�Ŀ��飬�ѶȲ���


 �ƸԹھ��ο���ϵ�д�
�ƸԹھ��ο���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 926kJ | B�� | 463 kJ | C�� | 402.5kJ | D�� | 23115 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ | B�� | ��Ѫ�� | C�� | ҹä֢ | D�� | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2O��g���TH2O��l�� | B�� | CO2+Ca��OH��2�TCaCO3��+H2O | ||
| C�� | NH3+HCl�TNH4Cl | D�� | NH4Cl$\frac{\underline{\;\;��\;\;}}{\;}$NH3��+HCl�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 90mL����ƿ��7.2g | B�� | 100mL����ƿ��8.0g | ||
| C�� | 100mL����ƿ��7.2g | D�� | 250mL����ƿ��20.0g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Fe�����ᷴӦ��Fe+2H+=Fe2++H2�� | |
| B�� | ����ʯ��ϡ���ᷴӦ��CO32-+2H+=CO2��+H2O | |
| C�� | FeCl2��Һ��Cl2�ķ�Ӧ��Fe2++Cl2=Fe3++2Cl- | |
| D�� | Cl2��H2O��Ӧ��Cl2+H2O=2H++Cl-+ClO- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���� | B�� | NaCl | C�� | ˮ | D�� | ����̼ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com