
����Ŀ��������(H3PO2)��һ�־�ϸ������Ʒ�����н�ǿ��ԭ�ԡ��ش��������⣺
(1)H3PO2��һԪ��ǿ�ᣬд������뷽��ʽ��____________��
(2)H3PO2��NaH2PO2���ɽ���Һ�е�Ag����ԭΪ�����Ӷ������ڻ�ѧ������
��H3PO2�У�PԪ�صĻ��ϼ�Ϊ___________��NaH2PO2___________ (��ܡ����ܡ�)��NaOH��Ӧ��
������H3PO2���л�ѧ������Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ4��1������������Ϊ________(�ѧʽ)��
(3)H3PO2�Ĺ�ҵ�Ʒ��ǣ�������(P4)��Ba(OH)2��Һ��Ӧ����PH3�����Ba(H2PO2)2����������H2SO4��Ӧ��д��������Ba(OH)2��Һ��Ӧ�Ļ�ѧ����ʽ��____________________��
(4)H3PO2Ҳ���õ��������Ʊ��������ҵ�������������ԭ����ͼ��ʾ(��Ĥ����Ĥ�ֱ�ֻ���������ӡ�������ͨ��)��
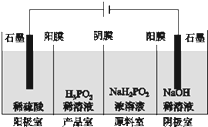
��д�������ĵ缫��Ӧʽ______________________________________________��
�ڷ�����Ʒ�ҿɵõ�H3PO2��ԭ��______________________________________________��
���𰸡�H3PO2![]() H2PO2����H����1����H3PO42P4��3Ba(OH)2��6H2O��3Ba(H2PO2)2��2PH3��2H2O��4e��=O2����4H�������ҵ�H��������Ĥ��ɢ����Ʒ�ң�ԭ���ҵ�H2PO2-������Ĥ��ɢ����Ʒ�ң����߷�Ӧ����H3PO2
H2PO2����H����1����H3PO42P4��3Ba(OH)2��6H2O��3Ba(H2PO2)2��2PH3��2H2O��4e��=O2����4H�������ҵ�H��������Ĥ��ɢ����Ʒ�ң�ԭ���ҵ�H2PO2-������Ĥ��ɢ����Ʒ�ң����߷�Ӧ����H3PO2
��������
(1)H3PO2��һԪ��ǿ�ᣬ��ˮ��Һ�ﲿ�ֵ������������Ӻ�������ӣ����뷽��ʽΪH3PO2H++H2PO2-���ʴ�Ϊ��H3PO2H++H2PO2-��
(2)��OԪ��Ϊ-2�ۡ�HԪ��Ϊ+1�ۣ����ݻ������л��ϼ۵Ĵ�����Ϊ0,����PԪ��Ϊ+1�ۣ�NaH2PO2Ϊ���Σ���������NaOH�����кͷ�Ӧ���ʴ�Ϊ��+1�����ܣ�
���÷�Ӧ������������������H3PO2�ǻ�ԭ�����������뻹ԭ�������ʵ���֮��Ϊ4��1������ת�Ƶ������֪��1molH3PO2ʧȥ4mol���ӣ����Է�Ӧ��PԪ��Ϊ+5�ۣ�������������H3PO4���ʴ�Ϊ��H3PO4��
(3)����(P4)��Ba(OH)2��Һ��Ӧ����PH3�����Ba(H2PO2)2����Ӧ����ʽΪ2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3�����ʴ�Ϊ��2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3����
(4)������������������Ϊ��������ӡ����������Ӻ�H2PO2-�����зŵ�������ǿ�������������ӣ������������ĵ缫��ӦΪ��2H2O-4e-=O2��+4H+���ʴ�Ϊ��2H2O-4e-=O2��+4H+��
����Ʒ�ҿɵõ�H3PO2��ԭ��Ϊ�������ҵ�H+������Ĥ��ɢ����Ʒ�ң�ԭ���ҵ�H2PO2-������Ĥ��ɢ����Ʒ�ң����߷�Ӧ����H3PO2���ʴ�Ϊ�������ҵ�H+������Ĥ��ɢ����Ʒ�ң�ԭ���ҵ�H2PO2-������Ĥ��ɢ����Ʒ�ң����߷�Ӧ����H3PO2��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У���������������ԭ�����͵���
A. ����ɫ��NO2����ѹ����ɫ�ȱ�����dz
B. ��ѹ�ȳ�ѹ�����ںϳ�SO3�ķ�Ӧ
C. ������������ڰ��ĺϳ�
D. ��ҵ��ȡ������Na(l)+KCl(l)![]() NaCl(l)+K(g)ѡȡ���˵��¶ȣ�ʹK��������ӷ�Ӧ������з������
NaCl(l)+K(g)ѡȡ���˵��¶ȣ�ʹK��������ӷ�Ӧ������з������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ�����Ԫ��a��b��c��d��e,��ԭ�Ӱ뾶��ԭ�������Ĺ�ϵ��ͼ,����˵����������
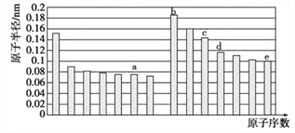
A. cԪ�ص����Ӱ뾶��e�����Ӱ뾶С
B. dԪ�ض�Ӧ������������ˮ�������Ա�eԪ����
C. b��c��d����Ԫ�ض�Ӧ������������ˮ��������ܷ�����Ӧ
D. a��b����Ԫ�ؿ��γɼ������Ӽ����зǼ��Թ��ۼ��Ļ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͬһ���ڵ�A��B��C��D���ֶ�����Ԫ�أ�����̬ԭ�ӻ��һ���������ų�������A>B>C>D��������˵���У���ȷ������Ԫ�صķǽ�����������ǿ����Ԫ�صĵ縺�����μ�С����Ԫ�صĵ�һ��������������������������Ӧˮ������������μ�����
A���٢� B���ڢ� C���٢� D���ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�����Ⱦ��˵������ȷ����(����)
A. ȼúʱ��������ʯ��ʯ���ɼ��ٷ�����SO2����
B. pH��5.6��7֮��Ľ�ˮͨ����Ϊ����
C. �⻯ѧ�������γ���Ҫ��NOx��̼�⻯�����й�
D. ����ϴ�Ӽ��ᵼ��ˮ����Ⱦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ϼ�G���������кܶ���;����ҵ�������л���A(![]() )���Ʊ�,��ϳ�·������:
)���Ʊ�,��ϳ�·������:

��֪:R1��CHO+R2��CH2��CHO ![]()
![]() (R1��R2������������ԭ��)
(R1��R2������������ԭ��)
�ش��������⣺
��1��C��������____��G�й����ŵ�������__________��
��2�����ķ�Ӧ������________��F�Ľṹ��ʽΪ_______________��
��3�����й���C��������ȷ����___________.
A. ����ʽΪC9H10O B. 1mol E�������5molH2�����ӳɷ�Ӧ
C. �����ܷ����Ӿۡ����۷�Ӧ D. �����9��̼ԭ��λ��ͬһƽ��
��4��C�ж���ͬ���칹��,�������ڷ����廯�������____�֡�
��5��д����Ӧ���Ļ�ѧ����ʽ__________________________________��
��6��F��ͬ���칹��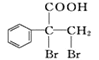 ��һ����Ҫ��ҩ���м�������ϳ�·����G����������Ϊԭ��������ĺϳ�·��(��������ԭ����ѡ)��____________
��һ����Ҫ��ҩ���м�������ϳ�·����G����������Ϊԭ��������ĺϳ�·��(��������ԭ����ѡ)��____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Zn��OH��2���ܶȻ�����Ϊ1.2��10��17��molL��1��3 �� ��Zn��OH��2��ˮ�е��ܽ��Ϊ�� ��
A.1.4��10��6molL��1
B.2.3��10��6molL��1
C.1.4��10��9molL��1
D.2.3��10��9molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У��������Ӽ����й��ۼ�����( )
A.MgCl2B.NH3C.NH4ClD.H2O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�������5 minʱ�����ͭ�缫����������2.16 g���Իش�

��1����Դ��X����________(���������)����
��2��ͨ��5 minʱ��B�й��ռ���224 mL(��״��)���壬��Һ���Ϊ200 mL(���ǰ����Һ������仯���Բ���)����ͨ��ǰc(CuSO4)��________��
��3����A��KCl��Һ�����Ҳ��200 mL��������Һ������Cl�����������Һ��c(OH-)��________��
��4��������̼�ǵ�������ЧӦ��������ף�Ŀǰ���Ǵ���������̼�ķ���֮һ��ʹ���������ϳ�Ϊ�״����״�������ȼ�ϵ�ص���Ҫȼ�ϡ���֪�������״�ȼ�յ��Ȼ�ѧ����ʽ���£�
2H2(g)��O2(g)===2H2O(l)�� ��H����570 kJ��mol��1����
2CH3OH(l)�� 3O2(g)===2CO2(g)��4H2O(l)����H����1452 kJ��mol��1����
д��������̼�������ϳɼ״�Һ����Ȼ�ѧ����ʽ��_________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com