
【题目】(1)常温常压下,等质量的CH4和A气体的体积之比为15:8,则A的摩尔质量为________。
(2)已知标准状况下,H2和O2的混合气体体积为11.2L,混合后总质量为13克,则混合气体的平均摩尔质量为_________,其中混有氧气的体积为__________。
(3)已知某种植物营养液配方如下:0.6mol KCl,0.4molK2SO4 ,0.2mol ZnSO4和1L水,若以KCl、K2SO4、ZnCl2和水来配制,则需KCl______mol,K2SO4___________mol,ZnCl2_____________mol。
(4)某固体物质A在一定条件下受热分解产物都是气体,有关化学方程式为:2A=B↑+2C↑+2D↑。若生成的混合气体对氢气的相对密度为d,则A的相对分子质量为_______(用d表示)。
【答案】30g/mol 26g/mol 8.96L 0.2mol 0.6mol 0.2mol 5d
【解析】
配制营养液时,我们可以利用离子守恒的原理,通过已知离子的物质的量,求出所需药品的物质的量。
(1)常温常压下,等质量的CH4和A气体的体积之比为15:8,则其物质的量之比为15:8,因为质量相等,所以二者的摩尔质量比为8:15,因为CH4的摩尔质量为16g/mol,所以A的摩尔质量为30g/mol;答案为30g/mol。
(2)混合气体的物质的量为![]() ,平均摩尔质量为
,平均摩尔质量为![]() ;设混合气中O2的物质的量为x mol,则H2的物质的量为0.5-x,32x+2(0.5-x)=13,解得x=0.4mol。标况下氧气的体积为0.4mol×22.4L/mol=8.96L;
;设混合气中O2的物质的量为x mol,则H2的物质的量为0.5-x,32x+2(0.5-x)=13,解得x=0.4mol。标况下氧气的体积为0.4mol×22.4L/mol=8.96L;
答案为:26g/mol;8.96L。
(3)按Zn2+守恒,可求出ZnCl20.2mol,根据Cl-守恒,可求出KCl 0.2 mol,根据K+守恒,或根据SO42-守恒,求出K2SO40.6mol;
答案为:KCl0.2mol;K2SO40.6mol;ZnCl20.2mol.。
(4)利用密度之比等于相对分子质量之比,可求出混合气的相对分子质量为2d。设A为2mol,则混合气为5mol,利用质量守恒可得:2mol×M(A)= 5mol×2dg/mol,从而求出M(A)=5dg/mol;
答案为:5d。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Na2O2可用作漂白剂和呼吸面具中的供氧剂。
(1)某学习小组发现:在盛有Na2O2的试管中加入足量水,固体完全溶解,并立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞溶液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量MnO2粉末,又有气泡产生。
①使酚酞溶液变红是因为__________,红色褪去的可能原因是__________________。
②加入MnO2反应的化学方程式为________________________________。
(2)Na2O2有强氧化性,H2具有还原性,有同学猜想Na2O2与H2能反应。为了验证此猜想,该小组同学进行如下实验,实验步骤和现象如下。
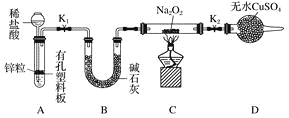
步骤1:按上图组装仪器(图中夹持仪器省略),检查气密性,装入药品。
步骤2:打开K1、K2,产生的氢气流经装有Na2O2的硬质玻璃管,一段时间后,没有任何现象。
步骤3:检验H2的纯度后,开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色。
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1。
①添加稀盐酸的仪器名称是____________;B装置的作用是________。
②必须检验氢气纯度的原因是__________________________________________________。
③设置装置D的目的是________________________________________________________。
④你得到的结论是____________(若能反应请用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A. ![]()
B. ![]()
C. ![]()
D. ![]() =1000Vρ/(17V+22400)
=1000Vρ/(17V+22400)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子的空间构型可用sp2杂化轨道来解释的是( )
①BF3 ②CH2=CH2 ③![]() ④CH≡CH ⑤NH3 ⑥CH4
④CH≡CH ⑤NH3 ⑥CH4
A. ①②③B. ①②④C. ③④⑤D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,Ca(OH)2和CaWO4(钨酸钙)的沉淀溶解平衡曲线如图所示。下列分析不正确的是
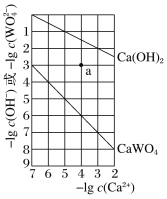
A. 常温时Ksp[Ca(OH)2]>Ksp(CaWO4)
B. a点:无Ca(OH)2沉淀,有CaWO4沉淀
C. 加热饱和Ca(OH)2溶液有白色沉淀生成
D. 常温时这两种饱和溶液中c(Ca2+)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_______、_________。(填标号)
A. B.
B.
C. D.
D.![]()
(2)![]() 与
与![]() 具有相同的电子构型,
具有相同的电子构型,![]() 小于
小于![]() ,原因是___________________________。
,原因是___________________________。
(3)![]() 是有机合成中常用的还原剂,
是有机合成中常用的还原剂,![]() 中的阴离子空间构型是____________________。
中的阴离子空间构型是____________________。

(4)如图,Li原子的第一电离能为_________![]() ,O=O键键能为_________
,O=O键键能为_________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
(1)用单线桥法表示该反应电子转移的方向和数目:___________。
(2)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是___________,转移电子的数目是_____________。
(3)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1∶1的混合液,反应的化学方程式是 _________________________ 。
(4)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应的离子方程式正确的是( )
A.氯气溶于水:Cl2+H2O=H++Cl-+HClO
B.Fe跟稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
C.将浓盐酸与MnO2混合加热:MnO2+2H++2Cl-![]() Mn2++Cl2↑+H2O
Mn2++Cl2↑+H2O
D.过氧化钠投入水中:Na2O2+2H2O=O2↑+2OH-+2Na+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com