
| A�������Һ������ʾ���ԡ����Ի����� |
| B�������Һ��һ������c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
| C����a>b��������Һ��c(C1-)=c(NH4+)+c(NH3��H2O) |
D���������Һ�����ԣ���NH3��H2O�ĵ���ƽ�ⳣ��Ϊ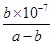 mol��L-1 mol��L-1 |
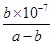 mol��L-1����ȷ��
mol��L-1����ȷ��

 ���б�ˢ��ϵ�д�
���б�ˢ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������Һ���ʵ���Ũ����ͬ |
| B����ͬŨ�ȵ������к�ʱ����������������ͬ |
| C������Һ��OH��Ũ����ͬ |
| D������������ˮϡ�ͺ�pH����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��NaCl(s) | B��CaCO3(s) | C��H2O | D��NaOH(s) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0.2 mol/L CH3COONa��Һ��0.1 mol/L HCl��Һ�������Ϻ�c��CH3COO������c��Na������c��Cl������c��H������c��OH���� |
| B��pH��3�������NaNO3�Ļ����Һ�У�c��Na������c��Cl���� |
| C��0.1 mol/L NaHCO3��Һ�У�c��Na������c��H������c��HCO3-����c��CO32-����c��OH���� |
| D�����ʵ���Ũ����ȵ�HCN�����ᣩ��NaCN��Һ�������Ϻ��У�c��HCN����2c��H������2c��OH������c��CN���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ����Ļ�ѧʽ | CH3COOH | HClO | H2CO3 |
| ����ƽ�ⳣ��(25 ��) | 1.8��10-5 | 3.0��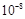 | K1=4.3��10-7 K2=5.6��10-11 |
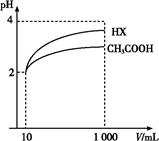
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ���� | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
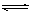 HClO + OH����ƽ�ⳣ��K��10��7.6
HClO + OH����ƽ�ⳣ��K��10��7.6�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| �� �� | NaHCO3 | Na2CO3 | NaCN |
| pH | 8.4 | 11.6 | 11.1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com