
����Ŀ����(Bi)λ��Ԫ�����ڱ��еڢ�A�壬���̬Ϊ��3ʱ���ȶ���������(NaBiO3)��Һ����ɫ����ȡһ������������(MnSO4)��Һ�����������εμ�������Һ����Ӧ�����������ʾ��

������ʵ�������£����н�����ȷ����
A.BiO3-��������ǿ��MnO4-
B.H2O2������������ӻ�ԭ��O2
C.H2O2���������ԣ��ܰ�KI������I2
D.��KI-������Һ�еμ���������Һ����Һһ������ɫ
���𰸡�A
��������
A. ����ɫ������(MnSO4)��Һ�м���������ɫ������(NaBiO3)��Һ����ַ�Ӧ����Һ��Ϊ�Ϻ�ɫ��˵����Ӧ������MnO4-��MnԪ�ػ��ϼ����ߣ�ʧȥ���ӱ�����ΪMnO4-������������ԭ��Ӧ�Ĺ��ɣ���������������ǿ����������������ԣ���֪BiO3-��������ǿ��MnO4-��A��ȷ��
B. �����ɫ��Һ�м������H2O2����Һ�ĺ�ɫ��ʧ���������ݣ�˵��������O2����Ԫ�ػ��ϼ����ߣ�ʧȥ���ӣ�����������H2O2�������������������O2��B����
C. ����Һ�м�������KI-������Һ����Һ������Ϊ��ɫ��������H2O2��KI����ΪI2��Ҳ������Mn2+������ʹH2O2�ֽ������O2��KI����ΪI2��I2��������Һ��Ϊ��ɫ��C����
D. �����ƾ���ǿ�������ԣ����Խ�KI����ΪI2��I2��������Һ��Ϊ��ɫ��Ҳ���Խ�KI����ΪKIO3�������Һ��һ����Ϊ��ɫ��D����
�ʺ���ѡ����A��


 �ִʾ��ƪϵ�д�
�ִʾ��ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦC(s)+H2O(g)![]() CO(g)+H2(g)��һ�ɱ��ݻ����ܱ������н��У����������ĸı���䷴Ӧ���ʼ�����Ӱ����ǣ�������
CO(g)+H2(g)��һ�ɱ��ݻ����ܱ������н��У����������ĸı���䷴Ӧ���ʼ�����Ӱ����ǣ�������
������C���� �ڽ������������Сһ�� �۱���������䣬����N2ʹ��ϵѹǿ���� �ܱ���ѹǿ���䣬����N2ʹ����������
A.�٢�B.�ڢ�C.�٢�D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���һԪ��HA����Һ��KOH��Һ�������ϣ���������仯����ʵ���������±���
ʵ���� | ��ʼŨ��/(mol��L-1) | ��Ӧ����Һ��pH | |
c(HA) | c(KOH) | ||
�� | 0.1 | 0.1 | 9 |
�� | x | 0.2 | 7 |
��1��ʵ��ٷ�Ӧ�����ҺpH=9��ԭ����___�������ӷ���ʽ��ʾ����
��2��ʵ��ٺ�ʵ�����ˮ�ĵ���̶Ƚϴ����__������Һ����ˮ�������c(OH-)=__��
��3��x__0.2(������������������=��)����x=a����������HA�ĵ���ƽ�ⳣ��Ka=__���ú�a�ı���ʽ��ʾ����
��4��������֪Ũ�ȵ�KOH�ζ�δ֪Ũ�ȵ�һԪ��HA���ζ��յ���жϷ�����__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������������������Ҫ�����á��ش��������⣺
(1)��֪4NH3(g)+5O2(g)=4NO(g)+6H2O(g)��H1=��alkJ/mol��4NH3(g)+6NO(g)=5N2(g)+6H2O(g)��H2=��bkJ/mol��H2O(1)=H2O(g)��H3=+ckJ/mol��д����298Kʱ������ȼ������N2���Ȼ�ѧ����ʽ___________��
(2)�����еļ��쵰��(Mb)����O2�������MbO2��Mb(aq)+O2(g)![]() MbO2(aq)������k����k���ֱ��ʾ����Ӧ���淴Ӧ�����ʳ�������V��=k����c(Mb)��P(O2)��V��=k����c(MbO2)��37��ʱ��ü��쵰�Ľ�϶�(��)��P(O2)�Ĺ�ϵ���±�[��϶�(��)ָ����O2��ϵļ��쵰��ռ�ܼ��쵰�İٷֱ�]��
MbO2(aq)������k����k���ֱ��ʾ����Ӧ���淴Ӧ�����ʳ�������V��=k����c(Mb)��P(O2)��V��=k����c(MbO2)��37��ʱ��ü��쵰�Ľ�϶�(��)��P(O2)�Ĺ�ϵ���±�[��϶�(��)ָ����O2��ϵļ��쵰��ռ�ܼ��쵰�İٷֱ�]��
P(O2) | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
����MbO2%�� | 50.0 | 67.0 | 80.0 | 85.0 | 88.0 | 90.3 | 91.0 |
�ټ���37�桢P(O2)Ϊ2.00kPaʱ��������Ӧ��ƽ�ⳣ��K=___________��
�ڵ���ƽ��ʱ���쵰����O2�Ľ�϶�(��)��O2��ѹǿ[P(O2)]֮��Ĺ�ϵʽ��=___________(�ú���k����k����ʽ�ӱ�ʾ)��
(3)���ɼ��쵰�ĸʰ���(NH2CH2COOH)��һ���������ʣ�����Һ��������������ʽ���ڣ���ת����ϵ���£�
![]()
![]()
![]()
![]()
![]()
�ڸʰ�����Һ�м�������������ӵİٷֺ������Ĺ�ϵ��ͼ��ʾ��
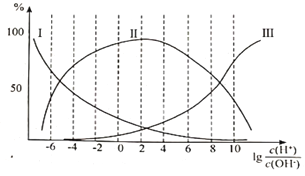
�ٴ��ʰ�����Һ��___________�ԣ�����Һ������ʱ�������ӵ�Ũ���ɴ�С��˳��Ϊ___________��
����![]() =8����Һ�м������HClʱ����Ӧ�����ӷ���ʽΪ___________��
=8����Һ�м������HClʱ����Ӧ�����ӷ���ʽΪ___________��
���õ�λ�ζ����ɲⶨij�ʰ�����Ʒ�Ĵ���.
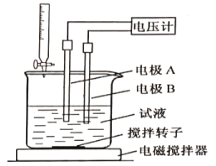
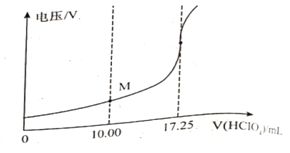
��ȡ��Ʒ150mg����һ�������£���0.1000mol/L�ĸ�������Һ�ζ�(��ʰ���1�U1������Ӧ)����õ�ѹ�仯�����HClO4��Һ�������ϵ����ͼ�����հ���ʵ�飬����HClO4��Һ�����Ϊ0.25mL������Ʒ�Ĵ���Ϊ___________%(����������һλС��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ºϳɵ�һ�����������Ϊ��������ṹ��
(1)�����������ķ���ʽ��_____��
(2) ���������������п����еĽṹ��_____������A��B��C��D��ѡ����
A��![]()
B��![]()
C��
D��![]()
(3) �������������ܷ����ķ�Ӧ��仯��_____������A��B��C��D��ѡ����
A����ʹBr2ˮ��ɫ��������Ӧ
B������ʹ���CCl4��Һ��ɫ
C���ܷ���ȡ����Ӧ
D���ܷ����ӳɷ�Ӧ
(4) ������������һ��ͬ���칹��Ϊ���������˷������ܷ����Ӿ۷�Ӧ����ṹ��ʽΪ_____�������ļӾ۷�Ӧ��ѧ����ʽΪ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��EΪԭ��������������Ķ���������Ԫ�أ��ֲ���������ͬ���ڡ�X��Y��Z��WΪ��ЩԪ���γɵĻ����XΪ��Ԫ��������Ϊǿ����ʣ�W��ˮ��Һ�ʼ��ԣ����ʵ�ת����ϵ��ͼ��ʾ������˵������ȷ����
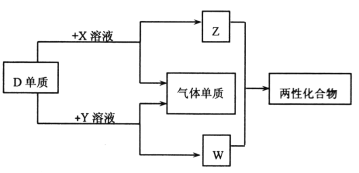
A. ��Ӧ�ļ����Ӱ뾶��C>D>B
B. D��E�γɵĻ�����Ϊ���м��Թ��ۼ��Ĺ��ۻ�����
C. ���C��E�γɵĻ�����ˮ��Һ��������C��E��Ӧ�ĵ���
D. ��A��B��E�γɵĻ����ﶼ���й��ۼ�����Һ����ǿ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����KOHΪ����ʵ�ѭ������п�������ε�طŵ�ʱ���ܷ�ӦΪ2Zn+O2=2ZnO������ʱ���ñý�п������Һ�γɵĽ����������ڲ�������Ӧ����Ӧ�����ɵIJ����潬��������غ���������ⲿ�ĵ����У�����ԭ�������������أ�ѭ������п-�������ε�ع�������ͼ��ͼ��ʾ������˵��������ǣ� ��
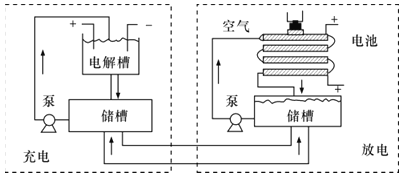
A.�ŵ�ʱ�����������ӦΪO2+4e-+2H2O=4OH-
B.�ŵ�ʱ��������л���������̼����
C.���ֹͣ����ʱ��п����������Һ����Ӧ
D.���ʱ������������ӦΪZnO+2e-+H2O=Zn+2OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���������
A. 0.1mol/L��Na2CO3��Һ������ˮϡ�ͺ���Һ��![]() ���
���
B. ��ʹNa2S��Һ��![]() �ӽ���2�U1���ɼ���������KOH����
�ӽ���2�U1���ɼ���������KOH����
C. 25��ʱ��Ũ�Ⱦ�Ϊ0. 1mol/L NaOH��NH3��H2O�����Һ��c(OH�� )>c(Na+ )=c(NH3��H2O)
D. 0.2 mol/L CH3COOH��Һ��0. 1mol/L NaOH��Һ�������ϣ�2c(H+)��2c(OH ��)=c(CH3COO��)��c(CH3COOH)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�������Һ��һ�������������������( )
A.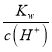 =0.1 mol L1 ����Һ��Na+��K+��CO32����NO3��
=0.1 mol L1 ����Һ��Na+��K+��CO32����NO3��
B.���д��� S2-����Һ�У�K+��Fe3+��ClO����SO42��
C.��ʹ Al3+���ɳ�������Һ�У�NH4+��Na+��SiO32����HCO3��
D.ˮ��������� c(OH��)��1��10��10 mol/L ����Һ�У�Fe2+��SO42����NO3����Cl��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com