
【题目】下面是甲、乙、丙三位同学制备乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
(实验目的) 制取乙酸乙酯
(1).(实验原理) 甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯,浓硫酸作吸水剂和__________。
(2).(装置设计)甲、乙、丙三位同学分别设计了下列三套实验装置:
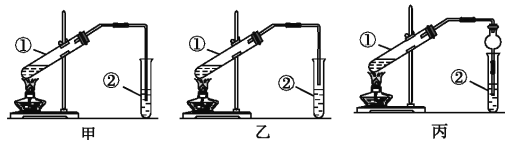
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,应选择的装置是______(填“甲”或“乙”)。丙同学将甲装置中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是__________。
(实验步骤)
①按你选择的装置组装仪器,在试管中先加入3mL乙醇,然后边振荡试管①边慢慢加入2mL浓H2SO4和2mL乙酸;
②将试管①固定在铁架上;
③在试管②中加入适量的饱和Na2CO3溶液;
④用酒精灯对试管①缓慢加热;
⑤当观察到试管②中有明显现象时停止实验。
(3).(问题讨论)
a.步骤(1)装好实验装置,加入样品前还应检查__________;
b.根据试管②中观察到的现象,可知乙酸乙酯的物理性质有:无色油状液体、__________;
c.试管②中分离出乙酸乙酯的实验操作是__________。
d.写出制备乙酸乙酯的化学方程式:__________。
【答案】催化剂 乙 防止倒吸 装置的气密性 不溶于水、有香味 分液 CH3COOH+C2H5OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
【解析】
乙醇、乙酸与浓硫酸混合共热制取乙酸乙酯,浓硫酸的作用是做吸水剂和催化剂。因为乙醇和乙酸易挥发,所以该反应生成的乙酸乙酯中含有一定量的乙醇和乙酸。乙醇和乙酸都易溶于水,乙酸可与碳酸钠反应,且加热过程中反应器中的蒸气压不稳定,因此,导气管不能直接插入碳酸钠溶液以防引起倒吸,据此分析作答。
[实验原理]乙酸和乙醇在浓硫酸作用下发生酯化反应,生成乙酸乙酯和水,浓硫酸有吸水性,促进该反应向正反应方向移动,浓硫酸能加快反应速率,所以浓硫酸作催化剂和吸水剂;
[装置设计]乙酸和乙醇易溶于水,导管插入液面下容易发生倒吸,所以为了防止倒吸,导管不能插入液面以下,应该选乙装置;球形干燥管导气的同时也起到防倒吸作用,故答案为诶:乙;防止倒吸;
[问题讨论] a.步骤(1)装好实验装置,加入样品前还应检查装置的气密性;
b. 乙酸乙酯在混合液上层,说明乙酸乙酯不溶于水、密度比水小,还能够闻到香味,说明乙酸乙酯具有特殊香味,故答案为:不溶于水、有香味;
c. 乙酸乙酯不溶于饱和碳酸钠溶液,混合液会分层,分离乙酸乙酯的方法为分液;
d. 乙酸和乙醇在浓硫酸作用下发生酯化反应,生成乙酸乙酯和水,反应的化学方程式为:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】某同学结合所学知识探究Na2O2与H2能否反应,设计装置如下,下列说法正确的是

A. 装置A气密性的检查方法,直接向长颈漏斗中加水,当漏斗中液面高于试管中液面且高度不变说明气密性良好
B. 装置B中盛放硅胶,目的是除去A中挥发出来的少量水蒸气
C. 装置C加热前,用试管在干燥管管口处收集气体点燃,通过声音判断气体纯度
D. 装置A也可直接用于Cu与浓硫酸反应制取SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在一恒容密闭容器中,下列能表示反应:X(g)+2Y(g)![]() 2Z(g)一定达到化学平衡状态的是
2Z(g)一定达到化学平衡状态的是
①X、Y、Z的物质的量之比为1:2:2;②Y的消耗速率与Z的消耗速率相等;③容器中的压强不再发生变化;④单位时间内生成n mol Z的同时消耗nmol Y
A. ①② B. ①④ C. ③④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A(C5H10O2)具有果香味,可用作食品加香剂,还可用作天然和合成树脂的溶剂。
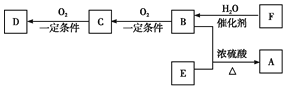
已知:①B、E分子中没有支链;②D能与碳酸氢钠溶液反应放出二氧化碳;③D、E具有相同官能团;E的相对分子质量比D大14;④F可以使溴的四氯化碳溶液褪色。
(1).B的化学名称为__________。D分子中所含的官能团的名称是__________。
(2).B与E生成A的反应类型是__________。
(3).写出F使溴的四氯化碳溶液褪色的化学反应方程式:__________。
(4).A的结构简式为__________。
(5).写出B与Na反应的化学方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组顺序的排列不正确的是( )
A. 熔点:金刚石>干冰 B. 稳定性:SiH4>H2S
C. 碱性:KOH>Al(OH)3 D. 离子半径:O2->Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的短周期元素,A是短周期中金属性最强的元素,B是地壳中含量最高的金属元素,C单质的晶体是良好的半导体材料,D的最外层电子数与内层电子数之比为3:5。
(1)C的原子结构示意图为______,D在元素周期表中的位置______。
(2)A单质在氧气中燃烧生成化合物甲,甲中所含化学键为________;A单质在E单质中燃烧生成化合物乙,用电子式表示乙的形成过程__________________。
(3)F是中学化学常见元素,它的一种氧化物为红棕色粉末,B单质与其在高温条件下反应是冶炼F单质的方法之一,该反应的化学方程式为________________。
(4)E元素的非金属性强于D元素,用原子结构解释原因:同周期元素随着原子序数的递增,______________________________,非金属性增强。
(5)工业上将干燥的E单质通入D熔融的单质中可制得化合物D2E2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,该反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确是
A.溴元素被称为“海洋元素”
B.I、Mg、Br、U元素属于海水中的微量元素
C.碘是人体必须微量元素,所以要多吃富含高碘酸的食物
D.Li、Cl、Na、K元素属于海水中的常量元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com