

(1)若沸腾炉中每燃烧
(2)反应2SO2+O2![]() 2SO3是在
2SO3是在
①接触室中SO2、O2、SO3共存
②接触室中SO2、O2、SO3的浓度相同
③接触室中SO2、SO3的物质的量之比为2∶1∶2
④接触室中压强不随时间变化而变化
(3)从沸腾炉出来的气体经净化干燥处理后进入接触室,其气体体积组成是:SO27%,O211%,N282%。若有100体积这样的混合气体在接触室反应,一段时间后,气体总体积变为96.7体积,则反应后混合气体中N2和O2的体积比为_________,此时SO2的转化率为_________。
(1)FeS2(s)+![]() O2(g)
O2(g)![]()
![]() Fe2O3(s)+2SO2(g);ΔH=-853 kJ·mol-1
Fe2O3(s)+2SO2(g);ΔH=-853 kJ·mol-1
(2)④
(3)82∶7.7 94.3%
解析:本题考查硫酸的工业制法。
①![]() O2(g)
O2(g) ![]()
![]() Fe2O3(s)+2SO2(g);ΔH=-853 kJ·mol-1。
Fe2O3(s)+2SO2(g);ΔH=-853 kJ·mol-1。
②反应2SO2+O2![]() 2SO3是不等体积的反应,所以只有达到平衡时物质的量不变,所以压强不变。本反应为可逆反应,所以接触室中SO2、O2、SO3一直共存,②③不一定。
2SO3是不等体积的反应,所以只有达到平衡时物质的量不变,所以压强不变。本反应为可逆反应,所以接触室中SO2、O2、SO3一直共存,②③不一定。
③由题意可知SO27体积,O211体积,N282体积。一段时间后,气体总体积变为96.7体积,则反应消耗SO26.6体积,O23.3体积,剩余O27.7体积,所以N2和O2的体积比为82∶7.7。
SO2的转化率=6.6/7×100%=94.3%。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
钒(V)及其化合物在工业催化、新材料和新能源等领域中有广泛的应用,其中接触法制硫酸工业中就要用到V2O5作催化剂:
2SO2(g)+O2(g) 2SO3(g) ΔH<0。
某温度下,将2mol SO2和1mol O2置于10 L密闭容器中,在V2O5作催化剂下经5min反应达平衡,SO2的平衡转化率(α)为80%。
(1)5min内 v(SO3 )= mol·L-1·min-1
(2)该温度下平衡常数K=
(3)若缩小容器体积,至达到新的平衡,在图中画出反应速率变化图象。
(4)硫酸工业尾气SO2用浓氨水吸收,反应的离子方程式是 ,吸收后的产物最终可制成肥料硫铵[即(NH4)2SO4]。
(5)某含钒化合物及硫酸的电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如下图所示。
①用该电池电解(NH4)2SO4溶液生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极电极反应式可表示为 ;若电解得1mol(NH4)2S2O8,则电池左槽中H+将 (填“增大”或“减少”) mol。
②电池使用一段时间后对其进行充电,充电过程中,阳电极反应式为: 。
查看答案和解析>>
科目:高中化学 来源:2012届浙江省衢州二中高三下学期第一次综合练习理科综合试卷(化学部分) 题型:填空题
钒(V)及其化合物在工业催化、新材料和新能源等领域中有广泛的应用,其中接触法制硫酸工业中就要用到V2O5作催化剂:
2SO2(g)+O2(g)  2SO3(g) ΔH<0。
2SO3(g) ΔH<0。
某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,在V2O5作催化剂下经5min反应达平衡,SO2的平衡转化率(α)为80%。
(1)5min内 v(SO3 )= mol·L-1·min-1
(2)该温度下平衡常数K=
(3)若缩小容器体积,至达到新的平衡,在图中画出反应速率变化图象。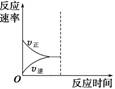
(4)硫酸工业尾气SO2用浓氨水吸收,反应的离子方程式是 ,吸收后的产物最终可制成肥料硫铵[即(NH4)2SO4]。
(5)某含钒化合物及硫酸的电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如下图所示。
①用该电池电解(NH4)2SO4溶液生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极电极反应式可表示为 ;若电解得1mol(NH4)2S2O8,则电池左槽中H+将 (填“增大”或“减少”) mol。
②电池使用一段时间后对其进行充电,充电过程中,阳电极反应式为: 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省高三下学期第一次综合练习理科综合试卷(化学部分) 题型:填空题
钒(V)及其化合物在工业催化、新材料和新能源等领域中有广泛的应用,其中接触法制硫酸工业中就要用到V2O5作催化剂:
2SO2(g)+O2(g)  2SO3(g) ΔH<0。
2SO3(g) ΔH<0。
某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,在V2O5作催化剂下经5min反应达平衡,SO2的平衡转化率(α)为80%。
(1)5min内 v(SO3 )= mol·L-1·min-1
(2)该温度下平衡常数K=
(3)若缩小容器体积,至达到新的平衡,在图中画出反应速率变化图象。

(4)硫酸工业尾气SO2用浓氨水吸收,反应的离子方程式是 ,吸收后的产物最终可制成肥料硫铵[即(NH4)2SO4]。
(5)某含钒化合物及硫酸的电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如下图所示。

①用该电池电解(NH4)2SO4溶液生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极电极反应式可表示为 ;若电解得1mol(NH4)2S2O8,则电池左槽中H+将 (填“增大”或“减少”) mol。
②电池使用一段时间后对其进行充电,充电过程中,阳电极反应式为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com