
| A. | 用蒸馏水湿润pH试纸后测定硫酸钠溶液的pH | |
| B. | 测定中和反应的反应热时,将碱溶液缓慢倒入酸溶液中 | |
| C. | 用酸碱中和滴定法测定未知浓度的碱液时,在锥形瓶中加入2-3mL酚酞试液作指示剂 | |
| D. | 在淀粉溶液中加入稀硫酸加热一段时间后,再滴加银氨溶液检验淀粉的水解产物 |
分析 A.使用pH试纸测定溶液酸碱性时,试纸湿润相当于将溶液稀释了;
B.测定中和反应的反应热时,将碱缓慢倒入酸中,导致热量损失过大;
C.指示剂的量过多,会影响滴定结果;
D.葡萄糖的银镜反应必须在碱性条件下进行.
解答 解:A.pH试纸湿润后,若测定中性溶液,不影响结果,所以用蒸馏水湿润pH试纸后测定硫酸钠溶液的pH,故A正确;
B.测定中和反应的反应热时,将碱缓慢倒入酸中,导致热量损失过大,所测温度值偏小,故B错误;
C.因为酸碱指示剂是弱酸,所以过多的酸碱指示剂会中和一部分碱.使得结果偏小,故C错误;
D.淀粉在酸性条件下水解生成葡萄糖,葡萄糖的银镜反应必须在碱性条件下进行,故D错误.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及实验基本操作、中和滴定、物质检验等,难度中等,理解实验进行的原理是解题的关键,注实验基本操作的掌握.


科目:高中化学 来源: 题型:选择题
| A. | 反应①是加成反应,反应②是取代反应 | |
| B. | 反应过程中可能会生成污染性气体 | |
| C. | C2H5OSO3H、乙醇均不能使酸性KMnO4溶液褪色 | |
| D. | 若不使用浓硫酸,乙烯仍能与水反应,但反应速率非常慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶都无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| B. | 铝丝先放在NaOH溶液中浸泡1min,取出用蒸馏水冲洗后放在浓硝酸中浸10min,最后放入CuSO4溶液中,铝丝表面无铜析出,说明Al常温下与CuSO4溶液不反应 | |
| C. | 用浓盐酸配制1:1(体积比)的稀盐酸(约6mol/L)通常需要用容量瓶等仪器 | |
| D. | 固体碘单质受热易升华,说明碘单质的热稳定性差 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液中一定含有Br-、SO42- | |
| B. | 原溶液一定含有Na+,不含Ba2+ | |
| C. | 实验①与上述离子的检验无关,可以省略 | |
| D. | 若要判断原溶液中是否含有Cl-,所需药品有CCl4溶液、Ba(NO3)2溶液和稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该物质属于盐类 | |
| B. | 该物质是Al(OH)3和Na2CO3的混合物 | |
| C. | 1mol NaAl(OH)2CO3最多可消耗3mol H+ | |
| D. | 该药剂不适合于胃溃疡患者服用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

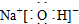 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com