
 ,不同元素之间形成的化学键极性共价键,该键形成的不对称分子是极性分子,
,不同元素之间形成的化学键极性共价键,该键形成的不对称分子是极性分子, ;极性;
;极性;  ,从该轨道表示式可以看出:最外层有2种不同能量的电子,
,从该轨道表示式可以看出:最外层有2种不同能量的电子,

科目:高中化学 来源: 题型:
| A、金属钠和氧气反应,条件不同,产物不同 |
| B、钠长期置于空气中,表面不能形成致密氧化膜 |
| C、钠与水反应时,钠熔成小球在水面四处游动 |
| D、由于钠比较活泼,所以它能从溶液中置换出金属活动性顺序表中钠后面的金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
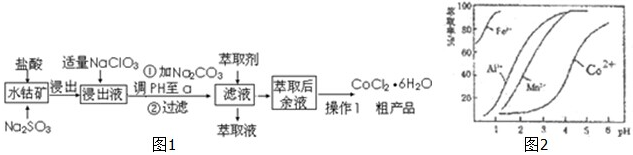
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、先加HCl无明显现象,再加BaCl2有白色沉淀,一定有SO42- |
| B、加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,则溶液中一定有CO32- |
| C、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
| D、透过蓝色钴玻璃观察到焰色为紫色,则待测液中一定含有钾元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:



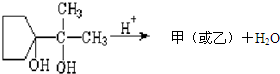
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
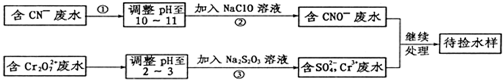
 某河道两旁有甲、乙两个化工厂.它们排放的澄清工业废水中,共含有Na+、Ag+、Fe3+、C1-、OH-、NO3-六种离子.
某河道两旁有甲、乙两个化工厂.它们排放的澄清工业废水中,共含有Na+、Ag+、Fe3+、C1-、OH-、NO3-六种离子.查看答案和解析>>
科目:高中化学 来源: 题型:


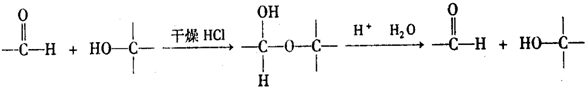

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com