

 ,D为CH2=CHCOOH,丙烯发生氧化反应得到C,C与银氨溶液反应得到丙烯酸,则C为CH2=CHCHO.E发生加聚反应生成F为
,D为CH2=CHCOOH,丙烯发生氧化反应得到C,C与银氨溶液反应得到丙烯酸,则C为CH2=CHCHO.E发生加聚反应生成F为 ,据此解答.
,据此解答. ,D为CH2=CHCOOH,丙烯发生氧化反应得到C,C与银氨溶液反应得到丙烯酸,则C为CH2=CHCHO.E发生加聚反应生成F为
,D为CH2=CHCOOH,丙烯发生氧化反应得到C,C与银氨溶液反应得到丙烯酸,则C为CH2=CHCHO.E发生加聚反应生成F为 ,
, ,含氧官能团名称是:羟基,F的结构简式为
,含氧官能团名称是:羟基,F的结构简式为 ,
, ;
;| △ |
| △ |
 ,其同分异构体含苯结构,羟基、甲基还有间位、对位两种,侧链可以为-OCH3或-CH2OH,符合条件的同分异构体共有4种,其中核磁共振氢谱中出现4组峰的有
,其同分异构体含苯结构,羟基、甲基还有间位、对位两种,侧链可以为-OCH3或-CH2OH,符合条件的同分异构体共有4种,其中核磁共振氢谱中出现4组峰的有 ,
, .
.


 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案科目:高中化学 来源: 题型:
| A、氧化铜与硫酸混合:O2-+2H+=H2O |
| B、澄清的石灰水跟盐酸反应:Ca2++2Cl-=CaCl2 |
| C、Fe和盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| D、石灰石和盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将过量的CO2通入Ca(ClO)2溶液中:H2O+CO2+Ca2++2ClO-=CaCO3↓+2HClO |
| B、将少量NaOH溶液加入到NH4HCO3溶液中:OH-+HCO3-=CO32-+H2O |
| C、Fe3O4与稀HNO3反应:Fe3O4+8H+=Fe2++2Fe3++4H2O |
| D、向NaHCO3溶液中加入少量Ca(OH)2:HCO3-+Ca2++OH-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 升高温度,平衡常数减小 |
B、 0~3内,反应速率为v(NO2)=0.2mol?L-1 |
C、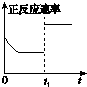 t1时仅加入催化剂,平衡正向移动 |
D、 达平衡时,仅改变x,则x为c(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
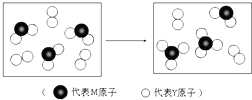
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 有关性质及结构信息 |
| A | A的一种原子内无中子 |
| B | B原子最外层电子数是内层电子数的2倍 |
| C | 一个C2-离子含10个电子 |
| D | A与D同族 |
| E | C与E同族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将NaOH溶液逐滴滴入FeSO4溶液中,只观察到白色沉淀 |
| B、将钠放入水中,钠浮在水面上、熔成一个闪亮的小球、四处游动、溶液变红 |
| C、除去表面保护膜的铝在酒精灯上加热到熔化,熔化的铝以小液滴的形式滴落下来 |
| D、在滴有酚酞溶液的 Na2SiO3溶液中,逐滴加入稀盐酸,溶液的红色逐渐变浅,并有白色胶状物生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 6 |
| 7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com