
| A. | 酸性 | B. | 酸性、氧化性 | ||
| C. | 酸性、还原性 | D. | 酸性、氧化性、还原性 |
科目:高中化学 来源: 题型:选择题
| A. | HA是一种强酸 | B. | 反应后溶液中c(OH-)<c(H+) | ||
| C. | c(A-)>c(B+)>c(H+)>c(OH-) | D. | 反应后混合溶液中还含有HA分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
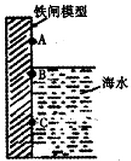 铁闸中的A、B、C三点中,C点的电极反应方程式为Fe-2e-=Fe2+将此铁闸与电源的负极相连可起到保护该铁闸的作用.对铁制品进行钝化处理可提高其抗腐蚀能力,下面是处理过程中的一个反应的方程式为:请配平该反应方程式.
铁闸中的A、B、C三点中,C点的电极反应方程式为Fe-2e-=Fe2+将此铁闸与电源的负极相连可起到保护该铁闸的作用.对铁制品进行钝化处理可提高其抗腐蚀能力,下面是处理过程中的一个反应的方程式为:请配平该反应方程式.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
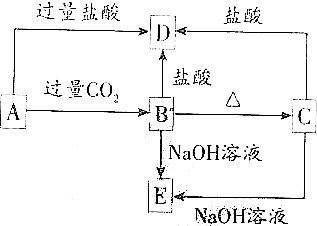 A、B、C、D、E五种化合物均含有某种短周期常见元素,它们的转化关系如图所示,其中A的溶液为澄清溶液,C为难溶于水的白色固体,E易溶于水,取A的溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)
A、B、C、D、E五种化合物均含有某种短周期常见元素,它们的转化关系如图所示,其中A的溶液为澄清溶液,C为难溶于水的白色固体,E易溶于水,取A的溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇与乙酸的酯化反应 | |
| B. | 乙醇在140℃时脱水生成乙醚 | |
| C. | 乙酸乙酯的水解反应 | |
| D. | 乙醇与H2SO4、溴化钠共热制取溴乙烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com