
分析 (1)碳酸钠是强碱弱酸盐,其溶液呈碱性;
(2)碳酸根离子水解导致溶液中氢氧根离子浓度大于氢离子浓度;
(3)a.完全电离的电解质是强电解质;
b.根据碳酸钠溶液中的物料守恒分析;
c.钠离子不水解,碳酸根离子水解导致溶液呈碱性,但水解程度较小;
(4)用石墨作电极电解Na2CO3溶液时,阴极上氢离子放电生成氢气;
(5)电荷守恒阳离子所带的正电荷数等于阴离子所以带负电荷总数,由此分析解答.
解答 解:(1)碳酸钠是强碱弱酸盐,碳酸根离子水解导致其溶液呈碱性,pH>7,
故答案为:<;
(2)碳酸根离子水解导致溶液中氢氧根离子浓度大于氢离子浓度,水解方程式为:CO32-+H2O?OH-+HCO3-,故答案为:CO32-+H2O?OH-+HCO3-;
(3)a.Na2CO3在水溶液完全电离,属于强电解质,故a正确;
b.根据碳酸钠溶液中的物料守恒可得:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol/L,故b正确;
c.钠离子不水解,碳酸根离子水解生成氢氧根离子和碳酸氢根离子,碳酸氢根离子水解生成碳酸和氢氧根离子,所以该溶液中离子浓度大小关系为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故c正确;
故答案为:abc;
(4)用石墨作电极电解Na2CO3溶液时,阴极上氢离子放电生成氢气,电极反应式为:2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(5)电荷守恒阳离子所带的正电荷数等于阴离子所以带负电荷总数,关系式为:2c(CO32-)+c(HCO3-)+c(OH-)=c(Na+)+c(H+),故答案为:2c(CO32-)+c(HCO3-)+c(OH-)=c(Na+)+c(H+).
点评 本题考查了离子浓度大小比较,题目难度中等,涉及盐类水解、电解池原理及离子浓度大小比较,根据盐的性质确定弱离子的水解,根据溶液酸碱性结合电荷守恒确定离子浓度大小,试题培养了学生的灵活应用能力.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ②③⑥⑧ | C. | ①④⑤⑦ | D. | ①②③⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅是良好的半导体材料 | |
| B. | 二氧化硅能与石灰石反应:SiO2+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑ | |
| C. | 可以用焦炭还原二氧化硅生产硅:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ | |
| D. | 水泥的主要成分是 Na2SiO3、CaSiO3 和 SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①③④ | C. | ②④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
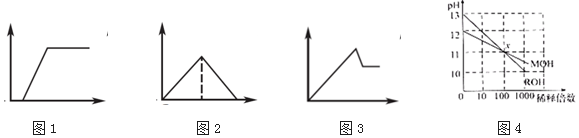
| A. | 图1:往Na2CO3和NaOH混合液中逐滴加入盐酸,产生气体体积与盐酸的物质的量的关系 | |
| B. | 图2:往澄清石灰水中通入过量CO2气体,产生沉淀质量与CO2的物质的量的关系 | |
| C. | 图3:往AlCl3和MgCl2混合液中逐滴加入NaOH溶液,产生沉淀质量与NaOH溶液的物质的量的关系 | |
| D. | 图4:若MOH和ROH表示两种一元碱,则ROH的碱性强于MOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(D)=0.01 mol/(L•s) | B. | v(C)=0.8 mol/(L•min) | ||
| C. | v(B)=0.02 mol/(L•s) | D. | v(A)=0.5 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | p(He)>p(H2)>p(N2) | B. | p(H2)>p(He)>p(N2) | C. | p(H2)>p(N2)>p(He) | D. | p(N2)>p(He)>p(H2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com