
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ③④ |
分析 根据金属活动性强弱关系铁>铜,可判断把铁粉加入硝酸铜溶液中,铁粉能置换出硝酸铜中的铜,同时生成硝酸亚铁溶液;若铁粉足量,则完全置换硝酸铜;若铁粉量不足,则部分置换硝酸铜;若铁粉过量,全部置换硝酸铜后铁粉有剩余.
解答 解:向硝酸铜溶液中加入过量的铁粉,充分反应后,所得固体为铁与铜的混合物,此时的溶液中只含硝酸亚铁,故情况④可能,若加入的铁粉恰好与硝酸铜完全反应,则得到的固体全部为铜,此时的溶液也只含硝酸亚铁;若加入的铁粉量不足,部分置换硝酸铜,所得固体全部为铜,此时的溶液为硝酸铜与硝酸亚铁的混合溶液,情况①可能,情况②③在溶液中存在硝酸铜的情况下铁粉有剩余是不可能出现的,因为铁粉会继续与硝酸铜反应;
故选B.
点评 本题难度中等,活动性强的金属放入活动性弱的金属的盐溶液中,盐溶液中活动性较弱的金属一定会被置换,直到活动性强的金属或盐被完全反应,主要考查了对金属活动性顺序的应用,从而培养学生对知识的应用能力,掌握基础是解题关键,题目较简单.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①③④ | C. | ②③⑥ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
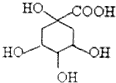 奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图,下列有关奎尼酸的说法中不正确的是( )
奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图,下列有关奎尼酸的说法中不正确的是( )| A. | 不能使溴的四氯化碳溶液褪色 | |
| B. | 能用碳酸氢钠溶液鉴别奎尼酸和苯 | |
| C. | 1 mol奎尼酸与足量钠反应生成56L氢气 | |
| D. | 与乙醇、乙酸均能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用铁作电极电解饱和氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 高锰酸钾在酸性介质中与草酸反应:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8 H2O | |
| C. | FeCl2与K3[Fe(CN)6]反应:2Fe2++3[Fe(CN)6]3-═Fe2[Fe(CN)6]3↓ | |
| D. | 向KI和H2SO4的混合溶液中通入空气:4H++4I-+O2=2I2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1 FeCl3溶液中含有Cl-总数为0.6NA | |
| B. | 常温常压下,a mo1 O2与2a mo1 NO混合,降温得到混合气体中氧原子数小于4a NA | |
| C. | 2 mol NaHSO4晶体中含有阳离子的数目为4NA | |
| D. | 3g金刚石和4g石墨中的碳碳单键数目均为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6 g | B. | 2.4 g | C. | 3.2 g | D. | 4.8 g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
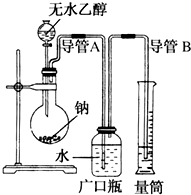 为了确定乙醇分子的结构简式是CH3-O-CH3还是CH3CH2OH,实验室利用右图所示的实验装置,测定乙醇与钠反应(△H<0)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子数目.试回答下列问题:
为了确定乙醇分子的结构简式是CH3-O-CH3还是CH3CH2OH,实验室利用右图所示的实验装置,测定乙醇与钠反应(△H<0)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子数目.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 1×l05 Pa | 5×l05 Pa | 10×l05 Pa | 50×l05 Pa | 100×l05 Pa | |
| 450℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 500℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com