
【题目】羰基硫(COS)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。
(1)羰基硫的结构与二氧化碳相似,电子式为______________,硫原子的结构示意图______________
(2)羰基硫的氢解和水解反应是两种常用的脱硫方法:
氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH1=+7kJ/mol
H2S(g)+CO(g) ΔH1=+7kJ/mol
水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) ΔH2=-34kJ/mol
H2S(g)+CO2(g) ΔH2=-34kJ/mol
已知:2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ/mol
表示CO燃烧热的热化学方程式为________。
(3)氢解反应平衡后保持温度和压强不变通入适量的He,则正反应速率___________,COS的转化率_______(填“增大”、“减小”或“不变”)。
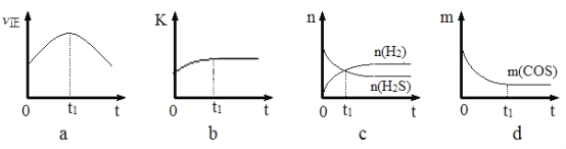
(4)若在绝热、恒容的密闭体系中,投入一定量COS(g)和H2(g),发生氢解反应,下列示意图能说明t1时刻反应达到平衡状态的是______(填字母序号)。(下图中υ正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)
(5)某温度下,在体积为2 L密闭的容器中通入2molCOS(g)和4molH2O(g)发生上述水解反应,5 min后达到平衡,测得COS(g)的转化率是75%,回答下列问题:
①v(H2S)=________mol/(L·min)
②该温度下平衡常数K=__________
【答案】 ![]()
![]() CO(g)+1/2O2(g)===CO2(g) △H= -283kJ/mol 减小 不变 bd 0.15 1.8
CO(g)+1/2O2(g)===CO2(g) △H= -283kJ/mol 减小 不变 bd 0.15 1.8
【解析】(1). 羰基硫的结构与二氧化碳相似,二氧化碳的电子式为:![]() ,所以羰基硫的电子式为:
,所以羰基硫的电子式为:![]() ,硫是16号元素,硫原子的结构示意图为:
,硫是16号元素,硫原子的结构示意图为:![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(2). 已知:① COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH1=+7kJ/mol,② COS(g)+H2O(g)
H2S(g)+CO(g) ΔH1=+7kJ/mol,② COS(g)+H2O(g)![]() H2S(g)+CO2(g) ΔH2=-34kJ/mol,③ 2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ/mol,根据盖斯定律,②+③÷2-①得:CO(g)+1/2O2(g)===CO2(g) △H= -283kJ/mol,故答案为:CO(g)+1/2O2(g)===CO2(g) △H= -283kJ/mol;
H2S(g)+CO2(g) ΔH2=-34kJ/mol,③ 2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ/mol,根据盖斯定律,②+③÷2-①得:CO(g)+1/2O2(g)===CO2(g) △H= -283kJ/mol,故答案为:CO(g)+1/2O2(g)===CO2(g) △H= -283kJ/mol;
(3). 氢解反应COS(g)+H2(g)![]() H2S(g)+CO(g)为反应前后气体分子数不变的可逆反应,平衡后保持温度和压强不变通入适量的He,容器体积增大,相当于减小压强,则正反应速率减小,因平衡不移动,所以COS的转化率不变,故答案为:减小;不变;
H2S(g)+CO(g)为反应前后气体分子数不变的可逆反应,平衡后保持温度和压强不变通入适量的He,容器体积增大,相当于减小压强,则正反应速率减小,因平衡不移动,所以COS的转化率不变,故答案为:减小;不变;
(4). a. t1时刻正反应速率仍然在变化,说明没有达到平衡状态,故a错误;b. 在绝热、恒容的密闭体系中发生氢解反应,t1时刻平衡常数不再变化,说明反应体系的温度不再变化,反应达到了平衡状态,故b正确;c. t1时刻氢气和硫化氢的物质的量相等,t1时刻之后二者的物质的量还在变化,说明反应没有达到平衡状态,故c错误;d. t1时刻COS的质量不再变化,说明反应达到了平衡状态,故d正确;答案选:bd;
(5). ①. 某温度下,在体积为2 L密闭的容器中通入2molCOS(g)和4molH2O(g)发生上述水解反应,5 min后达到平衡,测得COS(g)的转化率是75%,由反应方程式COS(g)+H2O(g)![]() H2S(g)+CO2(g)可知,达到平衡时生成H2S的物质的量为:n(H2S)=2mol×75%=1.5mol,则用H2S表示的反应速率为:v(H2S)=1.5mol÷2L÷5min=0.15 mol/(Lmin),故答案为:0.15;
H2S(g)+CO2(g)可知,达到平衡时生成H2S的物质的量为:n(H2S)=2mol×75%=1.5mol,则用H2S表示的反应速率为:v(H2S)=1.5mol÷2L÷5min=0.15 mol/(Lmin),故答案为:0.15;
②. 根据平衡三段式法有:
COS(g)+H2O(g)![]() H2S(g)+CO2(g)
H2S(g)+CO2(g)
起始浓度(mol/L): 1 2 0 0
转化浓度(mol/L):0.75 0.75 0.75 0.75
平衡浓度(mol/L):0.25 1.25 0.75 0.75
则该温度下平衡常数K=![]() =1.8,故答案为:1.8。
=1.8,故答案为:1.8。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】粗盐中除含有Ca2+、Mg2+、SO![]() 等可溶性杂质外,还含有泥砂等不溶性杂质。
等可溶性杂质外,还含有泥砂等不溶性杂质。
(1)检验溶液中含有SO![]() 的方法是_________________________________________________。
的方法是_________________________________________________。
(2)将粗盐溶解过滤除去不溶性杂质后,在滤液中依次滴加过量NaOH溶液、BaCl2溶液和Na2CO3溶液,直至不再产生沉淀。其中加入Na2CO3溶液的目的是___________________,滴加Na2CO3溶液时发生反应的化学方程式为________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,分析细胞内4种重要有机物的组成及功能,E、G、H都是生物大分子,回答下列问题:

(1)A一般是指_______;E在动物细胞中是指_______,在植物细胞中主要是_______。
(2)F是指_______,它是由B(甘油和脂肪酸)组成的。除F之外,脂质还包括_______和_______。
(3)C是________________
(4)D是指_______,生物体内的H分为_______和_______两大类。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极)。下列分析正确的是)

A. 电子流动方向为a→导线→b
B. H+经质子交换膜由右向左移动
C. 放电一段时间b极附近pH不变
D. a电极发生反应:H2N(CH2)2NH2+16e-+4H2O==2CO2↑+N2↑+16H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+![]() O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
则2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为
A. -870.3 kJ/mol B. -571.6 kJ/mol
C. +787.0 kJ/mol D. -488.3 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是( )
A.硫酸、CuSO45H2O、苛性钠
B.硫酸、空气、纯碱
C.氧化铁、胆矾、熟石灰
D.硝酸、食盐水、烧碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列平衡体系中,升温或减压都能使平衡向正反应方向移动的是
A. N2(g) + 3H2(g) ![]() 2NH3(g) ΔH < 0
2NH3(g) ΔH < 0
B. N2(g) + 2O2 (g)![]() 2NO2 (g) ΔH > 0
2NO2 (g) ΔH > 0
C. C(s) + 2H2O(g) ![]() CO2(g) + 2H2(g) ΔH > 0
CO2(g) + 2H2(g) ΔH > 0
D. 2SO2(g) + O2(g)![]() 2SO3(g) ΔH < 0
2SO3(g) ΔH < 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有m克某气体,它由双原子分子构成,它的摩尔质量为M g/mol。若阿伏加德罗常数用NA表示,则:
①该气体的物质的量为________mol。
②该气体所含原子总数为________个。
③该气体在标准状况下的体积为________L。
(2)将质量比为14:15的N2和NO混合,则混合气体中N2和NO的物质的量之比为______,氮原子和氧原子的个数比为_______,该混合气体的平均摩尔质量为_________。
(3)同温同压下,质量相同的五种气体:① CO2 ② H2 ③ O2 ④ CH4 ⑤ SO2。
所占的体积由大到小的顺序是(填序号,下同)_________________;所含原子数由多到少的顺序是__________________________;密度由大到小的顺序是__________________。
(4)在标准状况下,由CO和CO2组成的混合气体13.44L,质量为20g,该混合气体中,CO的质量是__g,CO2的体积是_____升。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如右图,其中只有M为金属元素。下列说法不正确的是

A. 原子半径Z<M
B. Y的最离价氧化物对应水化物的酸性比X 的弱
C. X 的最简单气态氢化物的热稳定性比Z的小
D. Z位于元索周期表中第2 周期、第ⅥA族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com