
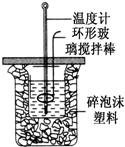
 用50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热.
用50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热.| 验验 编号 | 起始温度(℃) | 终止温度 (℃) | 温度差 (℃) | ||
| 盐酸 | 氢氧化钠 | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.4 | 24.8 | 24.65 | 27.8 | 3.15 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
| Q |
| n(H2O) |
| 3.25℃+3.15℃ |
| 2 |
| 1.3376kj |
| 0.025mol |


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
| A、乙烯和乙醇都能发生加聚反应 |
| B、制备乙酸乙酯时,向浓硫酸中缓慢加入乙醇和冰醋酸 |
| C、米酒变酸的过程涉及了氧化反应 |
| D、.K+、MnO4-、CH3CHO和SO42-在酸性条件下大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 某溶液先通入少量Cl2后,再加入淀粉溶液 | 溶液变蓝 | 该溶液中一定含有I- |
| B | 某溶液中加入硝酸酸化的氯化钡溶液 | 有白色沉淀生成 | 该溶液中一定含有SO42- |
| C | 将SO2通入酸性KMnO4溶液中 | 酸性KMnO4溶液褪色 | SO2具有漂白性 |
| D | 过量的Fe粉中加入HNO3充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在298 K时,11.2 L H2完全燃烧生成液态水放出的热量为142.9 kJ | ||
| B、H2(g)的燃烧热是285.8 kJ,则2H2O(l)═2H2(g)+O2(g)△H=+571.6 kJ?mol-1 | ||
| C、在298 K时,2H2(g)+O2(g)═2H2O(g)△H<-571.6 kJ?mol-1 | ||
D、H2(g)+
|
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com