
| A、植物油(水)--分液 |
| B、Fe(OH)3胶体(HCl)--渗析 |
| C、水(NaCl)--蒸馏 |
| D、CO2(HCl)--氢氧化钠溶液,洗气 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阳极100 g,阴极128 g |
| B、阳极93.6 g,阴极121.6 g |
| C、阳极91.0 g,阴极119.0 g |
| D、阳极86.0 g,阴极114.0 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
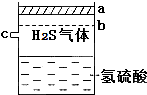 已知多元弱酸在水溶液中的电离是分步进行的,且第一步的电离程度大于第二步的电离程度,第二步的电离程度远大于第三步的电离程度…在密闭容器里盛有饱和H2S溶液和H2S气体,可上下移动的活塞停止在a处,如图所示.
已知多元弱酸在水溶液中的电离是分步进行的,且第一步的电离程度大于第二步的电离程度,第二步的电离程度远大于第三步的电离程度…在密闭容器里盛有饱和H2S溶液和H2S气体,可上下移动的活塞停止在a处,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸的化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 18×10-5 | 4.5×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A、等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2CO3)>pH(NaCN) |
| B、a mol?L-1HCN溶液与b mol?L-1NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b |
| C、向0.1 mol?L-1CH3COOH溶液中逐滴加水,则醋酸的电离程度增大、c(H+)减小 |
| D、NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蔬菜最好洗干净后再切 |
| B、炒蔬菜的时间不能太长,炒熟即可 |
| C、新鲜蔬菜应放在冰箱中储存 |
| D、把蔬菜放在高压锅中焖煮 |
查看答案和解析>>
科目:高中化学 来源: 题型:
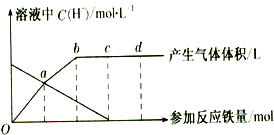
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com