
【题目】硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
![]()
①写出由纯SiHCl3制备高纯硅的化学反应方程式_____________________________。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、H2和另一种酸,写出并配平化学反应方程式_________________________________;H2还原SiHCl3过程中若混入O2,可能引起的后果是_________________________________________________。
(2)下列有关硅材料的说法正确的是________ 。
A.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高,硬度很大
(3)自然界中硅酸盐种类多,结构复杂,通常用二氧化硅和金属氧化物的形式来表示其组成.如正长石(KAlSi3O8),氧化物形式为_________________________________
(4)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入稀硝酸,产生的实验现象为_____________,水玻璃在工业上有许多用途,试举出一例____________________。
【答案】 SiHCl3+H2![]() Si+3HCl SiHCl3+3H2O= H2SiO3↓十3HCl↑+H2↑ 氧气与氢气混合,可能引起爆炸,氧气可能会氧化SiHCl3 B C K2O·AL2O3·6SiO2 试管中有白色胶状沉淀生成 制备硅胶、防火剂、防腐剂、粘合剂等(回答一个即可)
Si+3HCl SiHCl3+3H2O= H2SiO3↓十3HCl↑+H2↑ 氧气与氢气混合,可能引起爆炸,氧气可能会氧化SiHCl3 B C K2O·AL2O3·6SiO2 试管中有白色胶状沉淀生成 制备硅胶、防火剂、防腐剂、粘合剂等(回答一个即可)
【解析】(1)①根据原子守恒即质量守恒可知,三氯甲硅烷(SiHCl3)与H2反应生成硅和氯化氢,反应的化学方程式为:SiHCl3+H2![]() Si+3HCl;②SiHCl3和H2O剧烈反应生成H2SiO3、HCl和另一种物质,分析它们化合价的变化可知,
Si+3HCl;②SiHCl3和H2O剧烈反应生成H2SiO3、HCl和另一种物质,分析它们化合价的变化可知,![]() ,而Cl的化合价未发生变化,因此另一种元素即H元素的化合价必定降低,即另一种物质是H2,故反应方程式为SiHCl3+3H2O= H2SiO3↓十3HCl↑+H2↑;H2还原SiHCl3过程中若混入O2,可能引起的后果是氧气与氢气混合,可能引起爆炸,氧气可能会氧化SiHCl3;(2)A、盐酸不能与硅反应,而HCl在573 K以上的温度下可与硅发生反应,选项A错误;B、氮化硅为原子晶体,熔点高,性质稳定,可用于制作高温陶瓷和轴承,选项B正确;C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维,选项C正确;D、玻璃是一种玻璃态物质,无固定的熔点,选项D错误。答案选BC;(3)正长石(KAlSi3O8)改写成氧化物的形式为:K2O·AL2O3·6SiO2;(4)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入稀硝酸,产生的实验现象为试管中有白色胶状沉淀生成,水玻璃在工业上有许多用途,如制备硅胶、防火剂、防腐剂、粘合剂等。
,而Cl的化合价未发生变化,因此另一种元素即H元素的化合价必定降低,即另一种物质是H2,故反应方程式为SiHCl3+3H2O= H2SiO3↓十3HCl↑+H2↑;H2还原SiHCl3过程中若混入O2,可能引起的后果是氧气与氢气混合,可能引起爆炸,氧气可能会氧化SiHCl3;(2)A、盐酸不能与硅反应,而HCl在573 K以上的温度下可与硅发生反应,选项A错误;B、氮化硅为原子晶体,熔点高,性质稳定,可用于制作高温陶瓷和轴承,选项B正确;C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维,选项C正确;D、玻璃是一种玻璃态物质,无固定的熔点,选项D错误。答案选BC;(3)正长石(KAlSi3O8)改写成氧化物的形式为:K2O·AL2O3·6SiO2;(4)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入稀硝酸,产生的实验现象为试管中有白色胶状沉淀生成,水玻璃在工业上有许多用途,如制备硅胶、防火剂、防腐剂、粘合剂等。


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,它们的原子序数依次增大。已知A和B原子具有相同的电子层数,且A元素的最高正价与最低负价和为零,C是同周期中原子半径最大的元素,D是同周期中离子半径最小的元素。C的单质在加热条件下与B的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物F。试根据以上叙述回答:
(1)D元素在周期表中位置为_____________________;
(2)画出E的离子结构示意图_____________;写出ABE分子的结构式____________;
(3)工业上常用在微波条件下用A单质与EB2反应来解决其产生的环境问题,写出该化学方程式:___________________________________________;
(4)用电子式表示C2E的形成过程__________________________________________;
(5)1 mol F与A元素的最高价氧化物反应时转移的电子数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、L、M为核电荷数依次增大的前20号主族元素。X2是最轻的气体,Y、L与M三种元素的质子数均为5的倍数。回答下列问题:
(1)X与L组成的最简单化合物的电子式为。
(2)X与M组成的物质为(填“共价”或“离子”)化合物,该物质可作为野外工作的应急燃料,其与水反应的化学方程式为。
(3)Y在周期表中的位置是 , 其含氧酸的化学式为。
(4)L与M形成的化合物中L的化合价是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于溶液的下列说法正确的是( )
A.等体积、对物质的量浓度的NaX和弱酸HX混合后的溶液中:C(Na+)>c(HX)>c(X﹣)>c(H+)>c(OH﹣)
B.等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3中c(CO32﹣)的大小关系为:②>④>③>①
C.往0.1mol/L CH3COOH溶液中通入少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中 ![]() 增大
增大
D.Na2CO3溶液中,2c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是( )
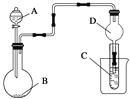
A. 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B. 若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D. 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向20mL,0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是( ) 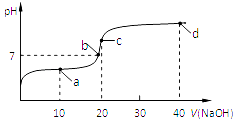
A.a点时:c(CH3COOH)>c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
B.b点时:c(Na+)=c(CH3COO﹣)
C.c点时:c(OH﹣)=c(CH3COOH)+c(H+)
D.d点时:c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两个体积相同的容器,一个盛有NO,另一个盛有N2和O2,在同温同压下两容器内的气体一定具有相同:①原子总数 ②质子总数 ③分子总数④质量
A.①②B.②③C.①③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】细胞中含量在万分之一以上的元素,称为大量元素;含量在万分之一以下的元素,称为微量元素。下列各组元素中,全部是大量元素的是( )
A.O S Mg C HB.Mo H O S Ca
C.Cu N P K FeD.P N K Ca B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性: ![]() >H2CO3>
>H2CO3> ![]() ,综合考虑反应物的转化率和原料成本等因素,将
,综合考虑反应物的转化率和原料成本等因素,将 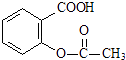 转变为
转变为 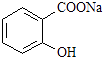 的最佳方法是( )
的最佳方法是( )
A.与稀H2SO4共热后,加入足量的NaOH溶液
B.与稀H2SO4共热后,加入足量的NaHCO3溶液
C.与足量的NaOH溶液共热后,再通入足量CO2
D.与足量的NaOH溶液共热后,再加入适量H2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com