
【题目】恒温恒容下.将l molX和2 molY置于密闭容器中发生反应:X(s)+2Y(g)![]() 2Z(g),10 min后达到平衡状态,下列说法正确的是
2Z(g),10 min后达到平衡状态,下列说法正确的是
A. 平衡前,容器中压强随反应进行而减小
B. 平衡后,容器中Y和Z的物质的量之比一定为1:1
C. 10 min后,升高温度,Y的反应速率不变
D. 生成Z的物质的量一定小于2 moI
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】对于在密闭容器中的可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 达到化学平衡状态时,4v正(O2)=5v逆(NO)
B. 当气体的平均相对分子质量不变时,反应达到平衡
C. 达到化学平衡状态时,若增加容器体积,则正反应速率减小,逆反应速率增大
D. 其他条件不变,增大体系压强,化学平衡常数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是 ( )


A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、油脂和蛋白质是维持人体生命活动所必需的三大营养物质。下列叙述中不正确的是( )
A.油脂在酸性或碱性条件下均可以水解
B.蔗糖、淀粉、纤维素水解的最终产物都是葡萄糖
C.葡萄糖可与新制的氢氧化铜悬浊液共热反应产生砖红色沉淀
D.蛋白质的颜色反应是指浓硝酸使蛋白质变黄
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学配制480 mL 0.5 mol/L NaOH溶液。
⑴ 该同学在实验过程中,用到的玻璃仪器有:量筒、玻璃棒、胶头滴管___________。
⑵ 其操作步骤如乙图所示,则甲图操作应在乙图中的____(填选项字母)之间。
A.①与② B.②与③ C.④与⑤ D.⑤与⑥


⑶ 该同学应称取NaOH固体___g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小_____(填小写字母),
并在下图中选出能正确表示游码位置的选项____(填大写字母)。
附表:砝码规格
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |
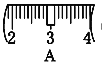

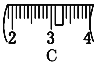
⑷ 该同学实际配制NaOH溶液的浓度为0.48 mol·L-1,原因可能是____(填序号)。
A.称量NaOH固体时,采用了“左码右物” B.容量瓶中原来存有少量水
C.溶解固体的烧杯移液后未洗涤 D.用胶头滴管加水定容时仰视刻度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101 kPa条件下,将15 L O2通入10 L CO和H2的混合气体中,使其完全燃烧,干燥后,恢复至原来的温度和压强.
⑴若剩余气体的体积是15 L,则原CO和H2的混合气体中V(CO)=________L,V(H2)=________L.
⑵若剩余气体的体积为a L,则原CO和H2的混合气体中V(CO)∶V(H2)=________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5mol (NH4)2S的质量为__g。
(2)标准状况下,1.7 g NH3与__LH2S气体含有的氢原子数相同。
(3)标准状况下,1.6g某气态氧化物RO2体积为0.56L,该气体的物质的量为__mol,RO2的相对分子质量为__。
(4)与0.2molH2含有相同电子数目的氦气分子的物质的量为_____。
(5)标准状况下, NH3与CH4组成的混合气体的平均密度为0.75g/L,该混合气体的平均摩尔质量为____,该气体对氢气的相对密度为___,NH3的体积分数为____。
(6)同温同压下,等体积的CO和CO2的物质的量之比__,所含氧元素的质量比__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A. 标准状况下,2.24 L H2O所含的原子数为0.5NA
B. 1 mL 1 mol/L NaCl溶液中离子总数为2NA
C. 18 g的H2O中含有的电子数为3NA
D. 标准状况下,22.4 L氩气所含质子数为18NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.19g/mL、质量分数为36.5%的浓盐酸配制230ml,1mol/L的盐酸。请回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为________,配制230ml,1mol/L的盐酸。
应量取浓盐酸的体积/mL | 实验需要的玻璃仪器(除烧杯、量筒) |
________ | ________ |
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是____。
A.溶液中HCl的物质的量 B.溶液的浓度 C.溶液中Cl-的数目 D.溶液的密度
(3)配制时,正确的操作顺序是(用字母表示,每个字母只能用一次)_____。
A.用30mL蒸馏水洗涤烧杯2-3次,洗涤液均注入容量瓶中,振荡
B.用量筒准确量取所需的浓盐酸,沿玻璃棒倒入烧杯中,再加入少量蒸馏水(35mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入所选容积的容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管滴加蒸馏水,使 __________________________________
F.往容量瓶内加蒸馏水,直到溶液在刻度线下1~2cm处
(4)若出现以下情况,对所配溶液浓度将有何影响?(填“偏高”“偏低”或“无影响”)
定容时俯视刻度线______________,定容后,盖上玻璃塞倒转摇匀,发现液面低于刻度线,继续滴加蒸馏水至刻度线_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com