
分析 (1)该反应中,16molHCl参与反应,被氧化生成氯气的HCl的物质的量为10mol,据此计算出73gHCl被氧化转移的电子数;
(2)根据电子守恒计算出生成氯气得到物质的量,然后根据m=nM计算出其质量.
解答 解:氧化还原反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,化合价升高的Cl元素被氧化,对应产物Cl2是氧化产物,化合价降低的Mn元素被还原,所在的反应物KMnO4是氧化剂,发生还原反应,
在反应的16molHCl(浓)中,被氧化的占10mol,未被氧化的HCl为6mol,被氧化与未被氧化的HCl的质量之比为5:3,当有10mol即365g盐酸被氧化时,转移电子的物质的量为10mol,生成的氯气物质的量为5mol,若有73gHCl被氧化,转移电子的物质的量为:$\frac{73g}{365g}$×10mol=2mol,生成氯气的物质的量为:$\frac{73g}{365g}$×5=1mol,
(1)根据分析可知,转移电子的物质的量为2mol,电子转移的总数为:1.204×1024,
答:电子转移的总数为1.204×1024;
(2)反应生成氯气的物质的量为1mol,质量为:71g/mol×1mol=71g,
答:反应生成氯气的质量为71g.
点评 本题考查了氧化还原反应的计算,题目难度中等,正确判断氧化剂、还原剂、氧化反应与还原反应为解答关键,转移熟练掌握氧化还原反应实质及特征,试题培养了学生的分析能力及化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 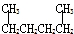 1,4-二甲基丁烷 1,4-二甲基丁烷 | B. | 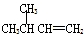 3-甲基丁烯 3-甲基丁烯 | ||
| C. | 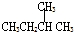 2-甲基丁烷 2-甲基丁烷 | D. | CH2Cl-CH2Cl 二氯乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应过程中能量关系如图所示,则该反应为放热反应 | |
| B. | 化学反应的反应热与反应方程式的计量数有关 | |
| C. | 若将该反应设计成原电池,锌为负极 | |
| D. | 若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤⑦ | B. | ②③④⑥⑧ | C. | ①②④⑨ | D. | ④⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 硫酸工业生产中用水吸收SO3 | SO3可与水反应 | Ⅰ对,Ⅱ对,有 |
| B | 铝材可用作装修材料 | 金属铝的导电性好 | Ⅰ对,Ⅱ对,无 |
| C | 向锅炉中加入Na2CO3溶液有利于除去锅炉中的硫酸钙 | 硫酸钙比碳酸钙更难溶 | Ⅰ错,Ⅱ错,无 |
| D | 氮化硅可用于制造高温陶瓷 | 氮化硅的硬度大且熔点高 | Ⅰ对,Ⅱ对,有 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种溶液中c(Cl-)的关系是①=②=③ | |
| B. | 若将三种溶液稀释相同的倍数,pH变化最小的是② | |
| C. | 三种溶液中由水电离出的c(H+)的关系是①<②<③ | |
| D. | 若向三种溶液中分别加入20mL0.1mol•L-1的NaOH溶液后,pH最小的是③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸工业的尾气中含有少量SO2,可用石灰水吸收,然后再用硫酸处理 | |
| B. | 工业上,常采用铁触媒催化剂,在400~500℃和10~30 MPa的条件下合成氨 | |
| C. | 造气中产生的CO,可在催化剂作用下,与水蒸气反应生成CO2和H2. | |
| D. | 在硫酸生产中,SO2催化氧化选择1~10 MPa、400~500℃条件下进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食品包装中的干燥剂必须用特别包装纸包装,其成分多为氧化钙颗粒,也有硅胶颗粒 | |
| B. | 蛋白质、塑料、合成橡胶、光导纤维都是高分子化合物 | |
| C. | Fe2O3、CuO、PbO等金属氧化物是我国古代就已经使用的用于烧碱釉陶的彩色釉面原料 | |
| D. | 控制汽车尾气、工业尾气、建筑扬尘、垃圾焚烧等的任意排放是治理雾霾天气重要环节 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com