
分析 因为:金刚石、石墨的燃烧热分别是395.0kJ/mol和393.5kJ/mol,则①C(s、金刚石)+O2(g)═CO2(g);△H=-395.0kJ•mol-1
②C(s、石墨)+O2(g)═CO2(g);△H=-393.5kJ•mol-1
利用盖斯定律将①-②可得:C(s、金刚石)=C(s、石墨);△H=(=-395.0kJ•mol-1)-(-393.5kJ•mol-1)=-1.5kJ•mol-1,该反应放热,说明金刚石的能量大于石墨,物质的能量越高,越不稳定,说明石墨较稳定,由此分析解答.
解答 解:因为:金刚石、石墨的燃烧热分别是395.0kJ/mol和393.5kJ/mol,则①C(s、金刚石)+O2(g)═CO2(g);△H=-395.0kJ•mol-1
②C(s、石墨)+O2(g)═CO2(g);△H=-393.5kJ•mol-1
利用盖斯定律将①-②可得:C(s、金刚石)=C(s、石墨);△H=(=-395.0kJ•mol-1)-(-393.5kJ•mol-1)=-1.5kJ•mol-1,该反应放热,说明金刚石的能量大于石墨,物质的能量越高,越不稳定,说明石墨较稳定,根据盖斯定律,C(s、石墨)=C(s、金刚石);△H=+1.5kJ•mol-1,
故答案为:C(s、金刚石)=C(s、石墨);△H=-1.5kJ•mol-1;石墨;吸热.
点评 本题考查反应热的计算,题目难度不大,注意盖斯定律的应用.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 用过滤的方法除去食盐水中的泥沙 | B. | 用蒸馏的方法将自来水制成蒸馏水 | ||
| C. | 用盐酸除去氧化铁中的氧化铝 | D. | 加热除去Na2CO3固体中的NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 卤素 | 氰 | 硫氰 | ① | |
| “单质” | X2 | (CN)2 | (SCN)2 | (OCN)2 |
| 酸 | HX | HCN | ② | HOCN |
| 盐 | KX | KCN | KSCN | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn+Ag2O+H2O═Zn(OH)2+2Ag | B. | Pb+PbO2+2H2SO4═2PbSO4+2H2O | ||
| C. | Zn+CuSO4═Cu+ZnSO4 | D. | CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2O5 | B. | NO | C. | NO2 | D. | N2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
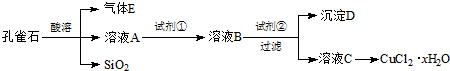
| 离子种类 pH | Fe3+ | Cu2+ | Fe2+ |
| 开始沉淀 | 2.7 | 5.4 | 8.1 |
| 沉淀完全 | 3.7 | 6.9 | 9.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装 置 | NaOH溶液的存放 | 固体物质的称量 | 向容量瓶中转移溶液 |
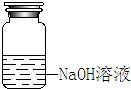 | 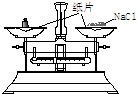 | 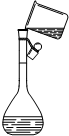 | |
| 错误之处 | 放在了带有磨口玻璃塞的广口瓶中 | 被称量的药品放在右边托盘 | 直接向容量瓶中转移溶液 |
| 如何改正 | 应放在带有橡胶塞的细口瓶中 | 应放在左边托盘中 | 应该用玻璃棒引流 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焓变是指1mol物质完全参加反应时的能量变化 | |
| B. | 中和滴定实验时,用待测液润洗锥形瓶 | |
| C. | 已知:2HI(g)?H2(g)+I2(g)△H=8.8kJ•mol-1,若向密闭容器中充入1molHI(g),则分解过程中吸收的热量为4.4kJ | |
| D. | 对于反应3H2(g)+N2(g)?2NH3(g),若使用催化剂,v正、v逆同等程度加快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com