
| 选项 | 方案 | 目的 |
| A | 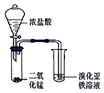 | 验证氧化性::Cl2>Br2 |
| B |  | 验证溶解度:AgCl>Ag2S |
| C | 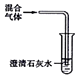 | 检验SO2、CO2混合气体中有CO2 |
| D | 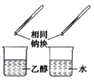 | 比较乙醇中羟基氢原子和水分子中氢原子的活泼性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.用浓盐酸和二氧化锰制备氯气,应在加热条件下反应;
B.含有硝酸银,不能证明氯化银的转化;
C.二者都与氢氧化钙反应;
D.加入相同的钠块,可根据反应的剧烈程度判断.
解答 解:A.反应没有加热,不能生成氯气,则实验不能完成,故A错误;
B.含有硝酸银,通入硫化氢生成硫化银沉淀,不能证明氯化银的转化,故B错误;
C.二者都与氢氧化钙反应,且反应现象相同,不能检验,故C错误;
D.加入相同的钠块,分子中氢原子越活泼,反应越剧烈,可完成实验,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、实验技能为解答的关键,侧重分析与实验能力的考查,题目难度不大,注意元素化合物知识与实验的结合.


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:选择题
| 实验操作 | 预测的实验现象 | 实验结论或解释 | |
| A | 向饱和Na2CO3 溶液中滴加少量稀盐酸 | 立即有气体逸出 | CO32-+2H+═H2O+CO2↑ |
| B | 将浓硫酸滴加到盛有铜片的试管中,并将 蘸有品红溶液的试纸置于试管口 | 品红试纸褪色 | SO2具有漂白性 |
| C | 铝箔在酒精灯火焰上加热 | 铝熔化但不会滴下 | A12O3的熔点比铝高 |
| D | 向淀粉的酸性水解液中滴入少量新制 Cu (OH)2悬浊液并加热 | 有砖红色沉淀生成 | 葡萄糖具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
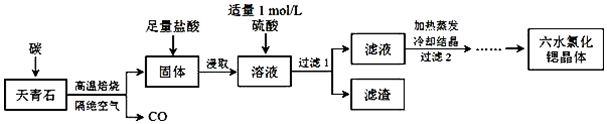
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:KOH>NaOH | B. | 金属性:Na>Mg | C. | 稳定性:HF>CH4 | D. | 酸性:HF<HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉的能量高于FeS | |
| B. | 铁粉和硫粉的反应常温下不能自发进行 | |
| C. | 该反应是放热反应 | |
| D. | 该反应不会产生污染物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将10%的葡萄糖溶液加入新制氢氧化铜悬浊液中,加热可得到砖红色沉淀 | |
| B. | 苯加入到溴水中,苯和溴发生取代反应而使溴水褪色 | |
| C. | 在洁净的试管中加入1~2 mL AgNO3溶液,再滴加稀氨水,直到AgOH完全沉淀,即制得银氨溶液 | |
| D. | 在空气中灼烧铜丝,待铜丝冷却后伸入乙醇中,反复多次,可以制得乙醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
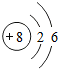 ,b的最简单氢化物的电子式为
,b的最简单氢化物的电子式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Rb与冷水反应比K更剧烈 | B. | Rb投入CuSO4溶液中可置换出Cu | ||
| C. | Rb与O2反应只有Rb2O产生 | D. | Rb2CO3难溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com