
 Y2(g)+3Z2(g)����Ӧʱ��(t)��������������ѹǿ(p)�����ݼ��±�
Y2(g)+3Z2(g)����Ӧʱ��(t)��������������ѹǿ(p)�����ݼ��±�| ʱ��t��min | 0 | 1 | 2 | 3 | 4 | 5 |
| ��ѹǿP l00 kPa | 4 | 4.6 | 5.4 | 5.8 | 6 | 6 |
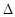 H=+67��7 kJ��mol-1��
H=+67��7 kJ��mol-1��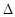 H="-534" kJ��mol-1��
H="-534" kJ��mol-1��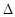 H= kJ��mol-1
H= kJ��mol-1 4NO+6H2O��4��10-12mol/L�����ڣ���5��k=[N2][H2]3/[NH3]2 50�G ��6��-1135.7
4NO+6H2O��4��10-12mol/L�����ڣ���5��k=[N2][H2]3/[NH3]2 50�G ��6��-1135.7


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
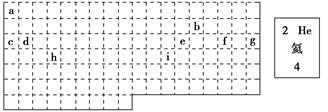
 X��ʾԭ�ӣ�
X��ʾԭ�ӣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO2(g)+H2(g)
CO2(g)+H2(g)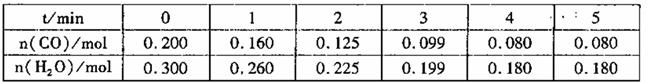
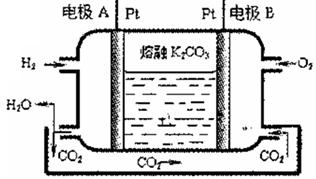
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������Ԫ�ص�ԭ�Ӱ뾶��rZ>rX>rY>rw |
| B��X��Y��Z��W�γɵĵ��������6�� |
| C������Ԫ�ؾ�������Ԫ���γ�18���ӷ��� |
| D������Ԫ���У�Z������������Ӧˮ����������ǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��һ��16Oԭ�ӵ�����Ϊ16 g |
| B��17O�����ԭ������ԼΪ17 |
C����Ԫ�ص����ԭ������Ϊ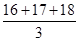 |
| D����Ԫ�ص����ԭ������Ϊ��16a%��17b%��18c%�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com