
(1)25 ℃时,0.1 mol·L-1 NaOH溶液的pH为 ;
(2)25 ℃时,0.1 mol·L-1 NH4Cl溶液的pH 7(填“<”“=”或“>”),其原因是 (用离子方程式表示);
(3)将上述两种溶液等体积混合后,离子浓度大小次序正确的是 (填序号)。
A.c(Na+)>c(Cl-)>c(OH-)>c(H+)
B.c(Na+)=c(Cl-)>c(H+)>c(OH-)
C.c(Na+)=c(Cl-)>c(OH-)>c(H+)
D.c(Cl-)>c(Na+)>c(OH-)>c(H+)
科目:高中化学 来源:2014年高二化学人教版选修四 2中和反应反应热的测定练习卷(解析版) 题型:选择题
已知盐酸与硫酸跟烧碱的稀溶液反应的热化学方程式为:H+(aq)+OH-(aq) H2O(l) ΔH=Q1 kJ·mol-1,又知:H2SO4(aq)+2KOH(aq)
H2O(l) ΔH=Q1 kJ·mol-1,又知:H2SO4(aq)+2KOH(aq) K2SO4(aq)+2H2O(l)ΔH=Q2 kJ·mol-1。则Q1和Q2的关系是( )
K2SO4(aq)+2H2O(l)ΔH=Q2 kJ·mol-1。则Q1和Q2的关系是( )
A.Q1=Q2B.2Q1=Q2C.Q1<Q2D.无法判断
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 19一次电池 二次电池练习卷(解析版) 题型:填空题
铅蓄电池是典型的可充型电池,电池总反应为:Pb+PbO2+4H++2S 2PbSO4+2H2O。
2PbSO4+2H2O。
请回答下列问题(不考虑氢、氧的氧化还原):
放电时,正极的电极反应是 ;电解液中H2SO4的浓度将变 ;当外电路通过1 mol电子时,理论上负极板的质量增加 g。
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 18原电池练习卷(解析版) 题型:选择题
下图是锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,在读书卡片上记录如下:
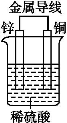

卡片上的描述合理的是( )
A.①②③B.③④⑤C.①⑤⑥D.②③④
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 17难溶电解质的溶解平衡练习卷(解析版) 题型:选择题
某温度下 ,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示,据图分析,下列判断错误的是( )
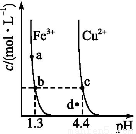
A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B.加适量NH4Cl固体可使溶液由a点变到b点
C.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 16盐类水解的应用练习卷(解析版) 题型:选择题
下列各步制取物质,最终无法达到目的的有( )
A.Al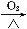 Al2O3
Al2O3 Al(NO3)3
Al(NO3)3 Al2O3
Al2O3
B.Cu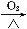 CuO
CuO CuSO4溶液
CuSO4溶液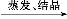 CuSO4·5H2O
CuSO4·5H2O
C.Fe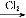 FeCl3
FeCl3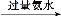 Fe(OH)3
Fe(OH)3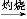 Fe2O3
Fe2O3
D.FeSO4溶液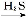 FeS
FeS FeS
FeS
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 15盐类水解的原理练习卷(解析版) 题型:填空题
(1)把NH4Cl晶体溶入水中,得到饱和NH4Cl溶液。若在该溶液中加入镁条,观察到有气泡产生,点燃有爆鸣声,此气体是 ,产生该气体的原因是 (用离子方程式表示),微热后,能放出有刺激性气味的气体,它能使湿润的红色石蕊试纸变蓝,该气体是 ,产生该气体的原因是 ,总的离子反应方程式为 。
(2)NH4Cl溶于重水后,产生的一水合氨和水合氢离子均正确的是( )
A.NH2D·H2O和D3O+B.NH3·D2O和HD2O+
C.NH3·HDO和D3O+D.NH2D·HDO和H2DO+
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 13pH的计算练习卷(解析版) 题型:填空题
一定温度下,有a.盐酸、b.硫酸、c.醋酸三种酸(用a、b、c回答)。
(1)当其物质的量浓度相同时。c(H+)由大到小的顺序是 ,pH由大到小的顺序是 。
(2)同体积、同物质的量浓度的三种酸溶液,中和NaOH的能力由大到小的顺序是 。
(3)当c(H+)相同时,物质的量浓度由大到小的顺序为 。
(4)当pH相同、体积相同时,分别加入足量锌,相同状况下产生的气体体积由大到小的顺序为 。
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修二 模块综合检测练习卷(解析版) 题型:填空题
工业上电解饱和食盐水能制取多种化工原料,其中部分原料可用于制备多晶硅。
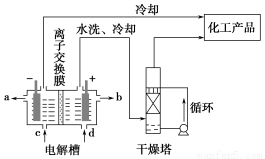
(1)上图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是________;NaOH溶液的出口为________(填字母);精制饱和食盐水的进口为________(填字母);干燥塔中应使用的液体是________。
(2)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。
①SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为___________________________________。
②SiCl4可转化为SiHCl3而循环使用,一定条件下,在20 L恒容密闭容器中的反应:
3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)
4SiHCl3(g)
达平衡后,H2和SiHCl3物质的量浓度分别为0.140 mol/L和0.020 mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为________kg。
(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0 kg,则生成氢气________m3(标准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com