
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. ![]()
B. ![]()
C. ![]()
D. ![]()
【答案】A
【解析】
A.实验室制氯气用二氧化锰与浓盐酸在加热条件下反应生成,氯气与硅在高温下生成SiCl4;
B.二氧化硫与次氯酸钙发生氧化还原反应,无法生成次氯酸;
C.铁片和浓硫酸钝化;
D.二氧化硅不溶于水,与水不反应。
A,实验室制氯气用二氧化锰与浓盐酸在加热条件下反应生成,氯气与硅在高温下生成SiCl4,均能实现,故A正确;
B.二氧化硫与次氯酸钙发生氧化还原反应,无法生成次氯酸,所以Ca( ClO)2 (aq)通SO2(g)生成HClO不能实现,故B错误;
C.铁片和浓硫酸钝化,所以浓H2SO4与Fe片生成SO2不能实现,故C错误;
D.二氧化硅不溶于水,与水不反应,所以SiO2与H2O生成H2SiO3不能实现,故D错误;
故选:A。


科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数
(1)一杯咖啡中含有0.194g咖啡因(分子式C8H10N4O2),你知道其中有___个咖啡因分子;这些咖啡因分子中的N原子的物质的量为__。
(2)若某单原子气体,一个该原子的真实质量为ag,则其摩尔质量是___,其标况下的密度是__g·L-1。
(3)0.2mol H2S中含___个电子;等物质的量的CH4和H2S中氢原子个数比是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示装置(部分仪器已略去)回答下列有关问题。
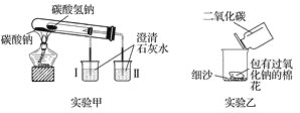
(1)实验甲在加热过程中能观察到产生白色沉淀的烧杯是________(填“Ⅰ”或“Ⅱ”),该烧杯中发生反应的离子方程式是________,通过实验甲可证明______(填“Na2CO3”或“NaHCO3”)更稳定。
(2)实验乙用来探究Na2O2与CO2的反应,观察到的实验现象为包有Na2O2的棉花着火。写出Na2O2与CO2反应的化学方程式:_________,棉花着火说明该反应的特点是_________
(3)取10 g碳酸钠和碳酸氢钠的混合物充分加热,将生成的CO2气体通入足量的澄清石灰水中,测得生成沉淀的质量为4.0 g。则原混合物中碳酸钠的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是 ( )
A.阿伏加德罗常数就是指6.02×1023
B.3.01×1023个Na+中电子的物质的量是5 mol
C.1 mol任何物质所含有的原子数都相同
D.2 mol SO42-约含有1.204×1023个SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用苯甲醛(C6H5CHO)在NaOH溶液中可以制苯甲醇(C6H5CH2OH)和苯甲酸(C6H5COOH)。实验流程如图:

相关物质的性质如下表所示。回答下列问题:
物质 | 对水的相对密度 | 沸点 | 溶解性 |
苯甲醇 | 1.04 | 205.7 | 微溶于水,易溶于乙醚 |
苯甲酸 | 1.27 | 249 | 微溶于冷水,可溶于热水,易溶于乙醚 |
乙醚 | 0.71 | 34.6 | 与水互不相溶 |
(1)操作①中,需要用到的玻璃仪器除烧杯外,还有____。操作①后,苯甲醇在容器中混合物的_____(填“上”或“下”)层。
(2)乙醚层用10%Na2CO3溶液洗涤的目的是_____。操作②前常需要加入MgSO4,作用是______。操作②的装置如图,指出该装置图中两个错误:______。

(3)操作③是______,操作④是______。
(4)取106.00g苯甲醛反应,若苯甲醛的转化率为80%,乙醚的萃取率为100%,洗涤等过程损失率为10%,则最终可制得苯甲醇___g(结果保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组欲配制245mL 0.1mol/L硫酸亚铁溶液,实验室有如下两种试剂:①FeSO4·7H2O,②5mol/LFeSO4溶液,现分两小组分别进行实验,第一小组选择试剂①,第二小组选择试剂②。
(1)第一小组称量试剂①的质量为__________g。
(2)第二小组经计算需要______mL5mol/LFeSO4溶液,在量取试剂②后,进行了下列操作:
a.等稀释的溶液的温度与室温一致后,沿玻璃棒注入容量瓶中。
b. ________使溶液的液面与瓶颈的刻度标线相切。
c.在盛FeSO4溶液的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
d.用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)____________。若量取的是浓硫酸,简述第c步实验的具体操作步骤:________
(3)在上述配制过程中,若出现以下情况,对溶液浓度有何影响?
A 用量筒量取试剂②时仰视观察凹液面。
B 稀释的FeSO4溶液未恢复至室温,沿玻璃棒注入容量瓶中。
C 未用蒸馏水洗涤烧杯和玻璃棒。
D 定容时,仰视观察凹液面。
E 定容后把容量瓶倒置摇匀,发现液面低于刻度线,又加水至刻度线。
F 配制溶液时,容量瓶中有蒸馏水。
偏高:______________ 偏低:____________ 无影响:_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,2.0×10-3mol·L-1氢氟酸水溶液中,通过加HCl气体或NaOH固体来调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:

下列分析正确的是
A. pH=1时,溶液中c(F-)+c(OH-)=c(H+)
B. pH=4时,溶液中存在:c(F-)>c(HF)>c(Na+)>c(H+)
C. 当溶液中c(F-)=c(HF)时,水的电离被促进
D. 将等物质的量的HF和NaF混合物溶于水,F-的水解能力小于HF的电离能力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在其他条件相同时,反应N2+O2=2NO分别在有、无催化剂时的能量变化如下图所示,下列说法中不正确的是( )
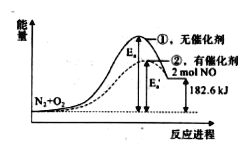
A. 该反应中反应物的总能量比生成物的总能量低
B. 0.2 mol NO完全分解成N2和O2时共放出热量18.26 kJ
C. 加入催化剂可以改变反应的活化能
D. 加入催化剂能改变反应的焓变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com