
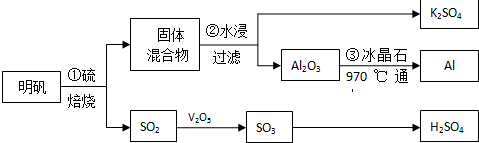
分析 从明矾[KAl(SO4)2•12H2O]制备Al、K2SO4和H2SO4的流程:过程①明矾和硫焙烧,4KAl(SO4)2•12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O,气体二氧化硫与氧气在五氧化二矾作催化剂的作用下生成三氧化硫,三氧化硫用98.3%的浓硫酸吸收,SO3+H2O=H2SO4,制得硫酸;过程②焙烧所得固体混合物,用水浸,为提高浸出率,可采取粉碎固体混合物、不断搅拌,从水浸后的滤液中蒸发结晶得到K2SO4晶体,步骤③电解Al2O3,制得Al,
(1)依据化学方程式4[KAl(SO4)2•12H2O]+3S═2K2SO4+2Al2O3+9SO2↑+48H2O中元素化合价变化可知,二氧硫既是氧化产物又是还原产物;
(2)矿石的颗粒大小、温度及是否搅拌等会影响浸取率;
(3)从水浸后的滤液中得到K2SO4晶体运用蒸发溶剂水的方法得到;
(4)步骤③电解Al2O3,制得Al,阳极材料需要定期地进行更换,原因是该极材料不断被消耗;
(5)放电时NiO(OH)转化为Ni(OH)2,Ni元素化合价降低,被还原,应为原电池正极反应;
(6)依据硫元素守恒计算得到.
解答 解:从明矾[KAl(SO4)2•12H2O]制备Al、K2SO4和H2SO4的流程:过程①明矾和硫焙烧,4KAl(SO4)2•12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O,气体二氧化硫与氧气在五氧化二矾作催化剂的作用下生成三氧化硫,三氧化硫用98.3%的浓硫酸吸收,SO3+H2O=H2SO4,制得硫酸;过程②焙烧所得固体混合物,用水浸,为提高浸出率,可采取粉碎固体混合物、不断搅拌,从水浸后的滤液中蒸发结晶得到K2SO4晶体,步骤③电解Al2O3,制得Al.
(1)4KAl(SO4)2•12H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O反应中,硫单质硫元素化合价0价,升高到SO2中为+4价,硫酸根离子中硫元素化合价从+6价变化为SO2中+4价,则S为还原剂,被氧化,KAl(SO4)2•12H2O为氧化剂,被还原,得氧化产物与还原产物的物质的量之比为1:2,
故答案为:1:2;
(2)由于酸浸时矿石颗粒大小影响浸取率,可以通过粉碎矿石提高浸取率,还可以适当升高温度或者搅拌提高浸取率,
故答案为:AC;
(3)从水浸后的滤液中得到K2SO4晶体运用蒸发结晶的方法得到,需要蒸发浓缩、冷却结晶、过滤、洗涤、干燥,
故答案为:蒸发结晶;
(4)电解熔融氧化铝,阳极氯离子放电生成氯气,阴极是铝离子放电生成铝,反应的化学方程式为2Al2O3 $\frac{\underline{\;\;\;\;\;冰晶石\;\;\;\;\;}}{970℃电解}$4Al+3O2↑,在冶炼过程中,阳极材料碳被氧气氧化成一氧化碳,反应为C+O2 $\frac{\underline{\;高温\;}}{\;}$CO2或2C+O2 $\frac{\underline{\;高温\;}}{\;}$2CO,所以需定期地进行更换,
故答案为:2Al2O3 $\frac{\underline{\;\;\;\;\;冰晶石\;\;\;\;\;}}{970℃电解}$4Al+3O2↑;阳极中碳被氧化成CO2(CO);
(5)放电时NiO(OH)转化为Ni(OH)2,Ni元素化合价降低,被还原,应为原电池正极反应,电极方程式为NiO(OH)+H2O+e-═Ni(OH)2+OH-,
故答案为:NiO(OH)+H2O+e-═Ni(OH)2+OH-;
(6)焙烧a吨明矾(摩尔质量为b g/mol),4KAl(SO4)2•12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O,生成SO2物质的量为:$\frac{a×106g/t}{bg/mol}$×$\frac{9mol}{4mol}$,SO2 的转化率为96%,物质的量为:$\frac{a×106g/t}{bg/mol}$×$\frac{9mol}{4mol}$×96%,可生产质量分数为98%的H2SO4质量为:$\frac{a×106g/t}{bg/mol}$×$\frac{9mol}{4mol}$×96%×$\frac{98g/mol}{98%×106g/t}$=$\begin{array}{l}\frac{9mol×98g/mol×96%×a}{4mol×bg/mol×98%}\end{array}$=$\frac{216a}{b}$,
故答案为:$\frac{a×106g/t}{bg/mol}$×$\frac{9mol}{4mol}$×96%×$\frac{98g/mol}{98%×106g/t}$=$\begin{array}{l}\frac{9mol×98g/mol×96%×a}{4mol×bg/mol×98%}\end{array}$=$\frac{216a}{b}$.
点评 本题以铝的化合物为载体考查了物质间的反应、物质的分离和提纯等知识点,明确物质之间的反应是解本题关键,再结合原子守恒来分析解答,这种综合性较强的题型是高考热点,需利用基础知识细心分析解答,题目难度中等.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 该溶液中:c2(H+)≠c(H+)•c(A-)+Kw | |
| B. | 0.1mol•L-1 HA溶液与0.05mol•L-1 NaOH溶液等体积混合,所得溶液中:2c(H+)+c(HA)═c(A-)+2c(OH-) | |
| C. | 浓度均为0.1mol•L-1的HA和NaA溶液等体积混合,所得溶液中:c(A-)>c(HA)>c(Na+)>c(OH-)>c(H+) | |
| D. | 由pH=3的HA溶液与pH=11的NaOH溶液等体积混合,所得溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
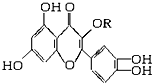 天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )
天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )| A. | 1mol该物质可与5molNaOH发生反应 | |
| B. | 1mol该物质与足量溴水反应,最多消耗6molBr2 | |
| C. | 一定条件下1mol该物质可与H2加成,消耗H2最大量为6mol | |
| D. | 维生素P能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ①②④⑤⑥ | C. | ①④⑤⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O和Na2O2的混合物共1mol,阴离子数目在NA~2NA之间 | |
| B. | 1mol OH-和1mol-OH (羟基)中含有的质子数均为9NA | |
| C. | 铁做电极电解食盐水,若阴极得到NA个电子,则阳极产生11.2L气体(标准状况下) | |
| D. | 某密闭容器盛有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件反应:2CO(g)?CO2(g)+C(s)可自发进行,则该反应的△H>0 | |
| B. | 向硫酸亚铁溶液中滴加硫氰化钾溶液产生血红色沉淀说明硫酸亚铁溶液已变质 | |
| C. | 升高CH3COONa溶液温度,其水的离子积常数和pH值都增大 | |
| D. | 相同物质的量浓度的下列溶液:①NH4HSO4②NH4Cl③NH3•H2O,水电离程度由大到小的顺序是:①>②>③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com