
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
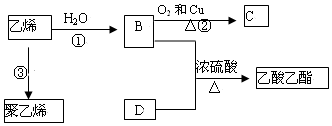
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
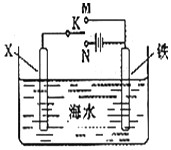 利用如图装置,可以模拟铁的电化学防护. 若X为碳棒,为减缓铁的腐蚀,开关K应该置于N(填M或者N)处,此时溶液中的阴离子向X极(填X或铁)移动.若X为锌,开光K置于M处,该电化学防护法称为:牺牲阳极的阴极保护法.
利用如图装置,可以模拟铁的电化学防护. 若X为碳棒,为减缓铁的腐蚀,开关K应该置于N(填M或者N)处,此时溶液中的阴离子向X极(填X或铁)移动.若X为锌,开光K置于M处,该电化学防护法称为:牺牲阳极的阴极保护法.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
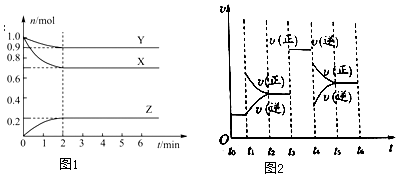
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2摩/升 | B. | 0.4摩/升 | C. | 0.8摩/升 | D. | 1.6摩/升 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
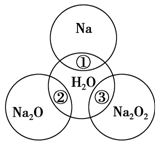 如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g,忽略溶液中溶剂的变化.完成下列题目.
如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g,忽略溶液中溶剂的变化.完成下列题目.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com