
原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物;Y与氧元素可组成Y2O和Y2O2离子化合物。
(1)写出Y2O2的电子式:_____________________,
其中含有的化学键是______________,属于晶体类型为________。
(2)用电子式表示Y2O的形成过程______________________。
(3)X、Z、W三种元素的最高价氧化物对应的水化物中,稀溶液氧化性最强的是________(填化学式)。
(4)XH3、H2Z和HW三种化合物,其空间构型分别为________、________、________。其中一种与另外两种都能反应的是______________(填化学式),其生成物晶体类型分别属于________、________。
(5)由X、W组成的化合物分子中,X、W原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式__________________________。
 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
合成氨工业、硫酸工业的生产工艺 流程如图所示 。
。
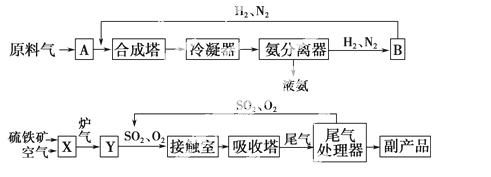
合成塔和接触室中的反应分别为
N2(g)+3H2(g) 2NH3(g) ΔH<0;
2SO2(g)+O2(g) 2SO3(g) ΔH<0。
(1)写出流程中设备的名称:B________,X________。
(2)进入合成塔和接触室中的气体都要进行热处理,最理想的热处理方法是___________________。
(3)采用循环操作可提高原料的利用率,下列生产中,采用循环操作的是________(填序号)。
①硫酸工业 ②合成氨工业 ③硝酸工业
(4)工业上常用98.3%的浓硫酸吸收SO3而不用稀硫酸或水的原因是_______________。
(5)工业生产中常用氨-酸法进行尾气脱硫,以达到消 除污染、
除污染、 废物利用的目的。硫酸工业尾气中的SO2经处理可以得到一种化肥,该肥料的化学式是___________________。
废物利用的目的。硫酸工业尾气中的SO2经处理可以得到一种化肥,该肥料的化学式是___________________。
(6)根据化学 平衡移动原理,下列条件或措施合理的是________(填序号)。
平衡移动原理,下列条件或措施合理的是________(填序号)。
①合成氨工业在高压下进行
②合成氨工业和硫酸工业都使用催化剂
③及时将氨液化而分离
④硫酸工业中,净化后的炉气中要有过量空气
⑤合成氨工业和硫酸工业都采用适宜的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造图如图(a)所示。

回答下列问题:
(1)①普通锌锰电池放电时发生的主要反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH。该电池中,负极材料主要是___ _________________,电解质的主要成分是__________,正极发生的主要反应是________________________________________________________。
_________________,电解质的主要成分是__________,正极发生的主要反应是________________________________________________________。
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是_______。
(2)图(b)表示回收利用废旧普通锌锰电池的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。
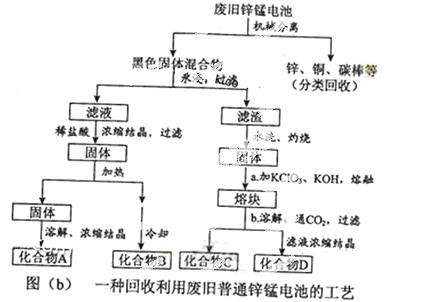
①图(b)中产物的化学式分别为A_______,B________。
②操作a中得到熔块的主要成分是K2MnO4。操作b中,绿色的K2MnO4溶液反应后生成紫色溶液和一种黑褐色固体,该反应的离子方程式为_______。
③采用惰性电极电解K2MnO4溶液也能得到化合物D,则阴极处得到的主要物质是____。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
石墨烯(如图甲)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图乙).
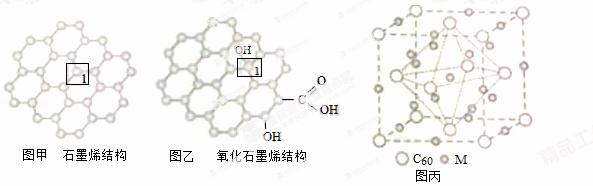
(1)图甲中,1号C与相邻C形成σ键的个数为 _________ .
(2)图乙中,1号C的杂化方式是 _________ ,该C与相邻C形成的键角 _________ (填“>”“<”或“=”)图甲中1号C与相邻C形成的键角.
(3)若将图乙所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有 _________ (填元素符号).
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱上与内部,该晶胞中M原子的个数为 _________ ,该材料的化学式为 _________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
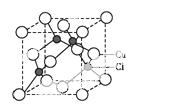
一水硫酸四氨合铜(Ⅱ)([Cu(NH3)4]SO4·H2O)是一种重要的染料及农药中间体。请回答下列相关问题:
(1)Cu的核外电子排布式为 。
(2)N的L层中有 对成对电子;N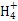 立体构型是 ,其中心原子的杂化方式为 。
立体构型是 ,其中心原子的杂化方式为 。
(3)氨水溶液中存在多种氢键,任表示出其中两种 ;
(4)[Cu(NH3)4]SO4·H2O中呈深蓝色的离子是 ,该微粒中的“电子对给予一接受键”属于 键;
(5)Cu的一种氯化物晶胞结构如图所示,该氯化物的化学式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
有原子序数依次增大的A、B、C、D、E五种元素,A是短周期中族序数等于周期数的非金属元素;B元素的原子既不易失去也不易得到电子,其基态原子每种轨道中电子数相同;C元素的价电子构型为nsnnpn+1;D的最外层电子数与电子层数之比为3∶1;E是地壳中含量仅次于铝的金属元素,其合金用途最广,用量最大。
(1)B与D形成的非极性分子中中心原子的孤对电子数是________,中心原子的杂化轨道类型为________。
(2)A分别与B、C、D能形成电子数为10的化合物,它们的沸点由高到低的顺序是____________(写分子式),它们的稳定性由弱到强的顺序是_______________________________________________________(写分子式)。
(3)分子ABC、BA2D的空间构型分别是________、________。
(4)B、C、D三种元素的电负性由大到小的顺序是_______ _(用元素符号表示),第一电离能由大到小的顺序是________(用元素符号表示)。
_(用元素符号表示),第一电离能由大到小的顺序是________(用元素符号表示)。
(5)C的单质分子中存在________个π键、________个σ键。
查看答案和解析>>
科目:高中化学 来源: 题型:
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
SiO2 + C+ N2 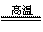 Si3N4 + CO
Si3N4 + CO
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应的氧化剂是 ,其还原产物是 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质的量的叙述中,错误的是( )
A.1 mol任何物质都含有6.02×1023个分子
B.0.012 kg 12C中含有约6.02×1023个碳原子
C.1 mol水中含有2 mol氢和1 mo l氧
l氧
D.1 mol Ne含有6.02×1024个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏伽德罗常数的值,下列叙述中不正确的是
A.分子总数为NA的NO2和CO2的混合气体中含有的氧原子数为2NA
B.28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
C.常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
D.常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com