
4种短周期元素在周期表中的相对位置如图所示,Y元素原子最外层电子数是其电子层数的3倍。下列说法中,正确的是
X | Y | |
Z | W |
A. X的氢化物可用作制冷剂
B. Y与氢元素形成的物质中只含有极性共价键
C. 4种元素的原子半径最大的是W
D. 4种元素中Z的最高价氧化物对应水化物的酸性最强
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源:2016-2017学年江西省高一3月月考化学试卷(解析版) 题型:填空题
A、B、C、D、E为原子序数依次增大的五种短周期主族元素,其中仅含有一种金属元素,A单质试自然界中密度最小的气体,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成A2C和A2C2两种常见的液态化合物.请回答下列问题:
(1)A元素的名称是____,D在周期表中的位置______.E的离子结构示意图___.
(2)B2分子的电子式:__,A2C的结构式:______.
(3)用电子式表示D2E化合物的形成过程为__.
(4)用含A元素最简单的有机化合物与赤热的氧化铜反应生成一种单质、液态氧化物和一可以使澄清石灰水变浑浊的气体,其化学方程式为_______.
(5)在100mL 18mol/L E的最高价氧化物对应水化物的溶液中加入过量的铜片,加热使之充分反应,铜片部分溶解.产生的气体在标准状况下的体积可能是____(填序号)
a.7.32L b.6.72L c.20.16L d.30.24L.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列离子方程式中,正确的是
A.铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑
B.氯气与氯化亚铁溶液反应:2FeCl2+Cl2=2FeCl3
C.氯化铁溶液与铁反应:Fe3++Fe=2Fe2+
D.氯化铁溶液与氢氧化钠溶液反应:Fe3++30H﹣=Fe(OH)3↓
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省益阳市高一下学期3月月考化学试卷(解析版) 题型:填空题
元素周期表的形式多种多样,下图是扇形元素周期表的一部分(前四周期的元素),对比中学常见元素周期表,回答下列问题:
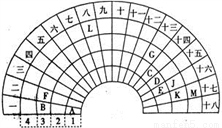
(1)E代表的元素处于常见周期表的位置是___________。G的离子结构示意图_____________。
(2)CE2的电子式是__________________。
(3)元素A和M形成的化合物的水溶液与元素K的单质反应的离子方程式为:__________________。反应后,向溶液中加入CK4溶剂,振荡后现象为____________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省益阳市高一下学期3月月考化学试卷(解析版) 题型:选择题
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构中如图所示,S2Cl2能和水反应2S2Cl2+2H2O=SO2↑+3S↓+4HCl下列说法中错误的是
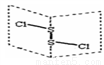
A. 反应中SO2是还原产物,S是氧化产物
B. S2Cl2分子中既有极性键又有非极性键
C. S2Cl2的结构式为Cl-S-S-Cl
D. S2Br2与S2Cl2结构相似,熔沸点:S2Br2 > S2Cl2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省益阳市高一下学期3月月考化学试卷(解析版) 题型:选择题
X、Y均为短周期元素,X位于IA族,X、Y能形成X2Y化合物,下列说法正确的是( )
A. X与Y形成的化合物中原子个数比可能为1 :1
B. X2Y不可能是共价化合物
C. X和Y分别形成的简单离子不可能具有相同电子层结构
D. 根据周期表递变规律判断X原子半径一定大于Y原子半径
查看答案和解析>>
科目:高中化学 来源:2017届宁夏银川市高三下学期第一次模拟考试理综化学试卷(解析版) 题型:填空题
已知A、B、C、D、E、F六种元素的原子序数依次递增,前四种元素为短周期元素。A位于元素周期表s区,电子层数与未成对电子数相等;B基态原子中电子占据三种能量不同的原子轨道,且每轨道中的电子总数相同;D原子核外成对电子数为未成对电子数的3倍;F位于第四周期d区,最高能级的原子轨道内只有2个未成对电子;E的一种氧化物具有磁性。
(1)E基态原子的价层电子排布式为__________________。第二周期基态原子未成对电子数与F相同且电负性最小的元素名称为____________。
(2)CD3- 的空间构型为_______________。
(3)A、B、D三元素组成的一种化合物X是家庭装修材料中常含有的一种有害气体,X分子中的中心原子采用_____________杂化。
(4)F(BD)n的中心原子价电子数与配体提供电子总数之和为18,则n=________。根据等电子原理,B、D 分子内σ键与π键的个数之比为______________。
(5)一种EF的合金晶体具有面心立方最密堆积的结构。在晶胞中,F位于顶点,E位于面心,该合金中EF的原子个数之比为_________________。若晶胞边长a pm,则合金密度为______________g·cm3(列式表达,不计算)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一下学期3月月考化学试卷(解析版) 题型:选择题
下图是另一种元素周期表——三角形元素周期表的一部分,图中标示了L、M、Q、R、T元素的位置,下列判断正确的是
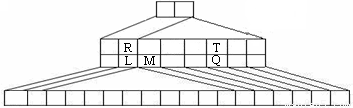
A.Q、T两元素的氢化物的稳定性为HnT<HnQ
B.L、R的单质与盐酸反应速率为R>L
C.M与T形成的化合物有两性
D.L、Q形成的简单离子核外电子数相等
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一下学期第一次月考化学试卷(解析版) 题型:选择题
若阿伏加德罗常数的数值用NA表示,下列说法正确的是
A.标准状况下,1.12L氦气所含原子数为0.1NA
B.1.6gNH2— 离子所含质子数为NA
C.22.4 LHCl溶于水,溶液中H+数为NA
D.9g D2O所含的中子数为4.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com