

���� ��������������������������������������������˺�õ�������Ϊ�������裬��Һ�м���������ۣ���������������Һ������pH�����̼�������Һ��������̼���������壬��ϴ�ӡ�����ڿ���������ʱ�����ֽ⣬��������е���������������ԭ��Ӧ����������������
��1����������������������������������������������˺�õ�������Ϊ�������裻
��2�����ݷ�����֪�������Ϊ���ˣ��ݴ��ж�����������������е���pHֵ���Լ�Ҫ�����ᷴӦ�Ҳ������µ����ʣ�
��3��������ǽ������ӻ�ԭ���������ӣ����鲽����Ѿ�������ȫ������Һ��û�������ӣ�
��4��������Ǽ���̼����鱗���̼��������Һ���¶ȹ�����������ˮ��̶�����ͬ��̼��������ֽ⣻
��5��������з�����ӦΪ̼�������ڿ���������������������ԭ��Ӧ����������������
��6���ټ���������H2O2������Ӧ���������ӱ����������������������ӣ����ԭ���غ�͵���غ���ƽ��д���ӷ���ʽ��
�ڸ������⣬���Ƶò�������bgΪ������������Ԫ�ص�����Ϊ$\frac{112}{160}$��bg=0.7bg��������Ԫ���غ��֪��Ʒ����Ԫ�ص�����Ϊ0.7bg���ݴ˼��㣻
��� �⣺��������������������������������������������˺�õ�������Ϊ�������裬��Һ�м���������ۣ���������������Һ������pH�����̼�������Һ��������̼���������壬��ϴ�ӡ�����ڿ���������ʱ�����ֽ⣬��������е���������������ԭ��Ӧ����������������
��1����������������Ҫ�ɷ�ΪFe3O4��Fe2O3��FeO��SiO2�������ܹ�����Fe3O4��Fe2O3��FeO�������ܽ⣬����������������������Բ�����ΪSiO2��
�ʴ�Ϊ��SiO2��
��2�����ݷ�����֪�������Ϊ���ˣ����˲������õIJ���������©�������������ձ��ȣ�������е���pHֵ���Լ�Ҫ�����ᷴӦ�Ҳ������µ����ʣ������ð�ˮ�Ϻã���ѡD��
�ʴ�Ϊ��©�������������ձ���D��
��3��������ǽ������ӻ�ԭ���������ӣ����鲽����Ѿ�������ȫ������Һ��û�������ӣ�������KSCN��Һ��
�ʴ�Ϊ��KSCN��Һ��
��4��������Ǽ���̼����鱗���̼��������Һ���¶ȹ�����������ˮ��̶�����ͬ��̼��������ֽ⣬�����¶�һ���������35�����£�
�ʴ�Ϊ����ֹNH4HCO3�ֽ⣬����Fe2+��ˮ�⣻
��5��������з�����ӦΪ̼�������ڿ���������������������ԭ��Ӧ������������������Ӧ����ʽΪ4FeCO3+O2$\frac{\underline{\;����\;}}{\;}$2Fe2O3+4CO2��
�ʴ�Ϊ��4FeCO3+O2$\frac{\underline{\;����\;}}{\;}$2Fe2O3+4CO2��
��6���ټ���������H2O2������Ӧ��������Һ���������ӱ����������������������ӣ���Ӧ�����ӷ���ʽΪ��2Fe2++H2O2+2H+=2Fe3++2H2O��
�ʴ�Ϊ��2Fe2++H2O2+2H+=2Fe3++2H2O��
�ڸ������⣬���Ƶò�������bgΪ������������Ԫ�ص�����Ϊ$\frac{112}{160}$��bg=0.7bg��������Ԫ���غ��֪��Ʒ����Ԫ�ص�����Ϊ0.7bg��������Ʒ��FeԪ�ص���������Ϊ$\frac{0.7b}{a}$��100%=$\frac{7b}{10a}$��100%��
�ʴ�Ϊ��$\frac{7b}{10a}$��100%��
���� ���⿼���������仯�������ʵķ���Ӧ�ã���Ҫ�����̷������⡢��Ӧ���̵��жϡ������Ʊ���ʵ�鷽����֪ʶ����Ŀ�Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
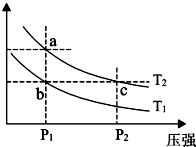 A��B��C��D��E��F���ֶ�����Ԫ�أ���ԭ������������������ B��Cͬ���ڣ�D��E��Fͬ���ڣ�A��D ͬ���壬C��Fͬ���壬CԪ�ص�ԭ�������������Ǵ�������������������֪����Ԫ�����γɵij��������ڳ��³�ѹ�������������壬�����ǹ��壮
A��B��C��D��E��F���ֶ�����Ԫ�أ���ԭ������������������ B��Cͬ���ڣ�D��E��Fͬ���ڣ�A��D ͬ���壬C��Fͬ���壬CԪ�ص�ԭ�������������Ǵ�������������������֪����Ԫ�����γɵij��������ڳ��³�ѹ�������������壬�����ǹ��壮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��
��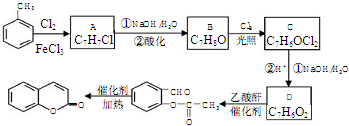
 ��A��B�ķ�Ӧ������ȡ����Ӧ��
��A��B�ķ�Ӧ������ȡ����Ӧ�� ����Ӧ��������
����Ӧ�������� �⣬ͬʱ���ɵ���һ�ֲ���Ľṹ��ʽ��CH3COOH��
�⣬ͬʱ���ɵ���һ�ֲ���Ľṹ��ʽ��CH3COOH�� ��Ϊͬ���칹�壬�Ҿ��������ص㣺
��Ϊͬ���칹�壬�Ҿ��������ص㣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��д��A�����й����ŵ������ǻ����Ȼ���
��д��A�����й����ŵ������ǻ����Ȼ��� ��
��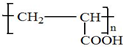 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ࡢ��֬�͵����ʶ��Ǹ߷��ӻ����� | |
| B�� | �Ҵ������ᶼ��������Ʒ�Ӧ�������� | |
| C�� | ���ۣ�C6H10O5��n����ά�أ�C6H10O5��n��Ϊͬ���칹�� | |
| D�� | ʯ�͵ķ����ú�ĸ����ֻ���������仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.8mol•L-1 | B�� | 0.6mol•L-1 | C�� | 0.4mol•L-1 | D�� | 0.2mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
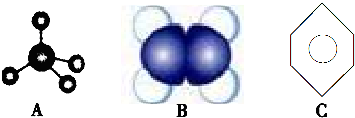
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ʳ��ˮ�У�c��Na+��+c��H+��=c��Cl-��+c��OH-�� | |
| B�� | ����С�մ���Һ�У�c��Na+��=c��HCO3-�� | |
| C�� | pH=4�Ĵ����У�c��H+��=4.0mol•L-1 | |
| D�� | pH=12�Ĵ�����Һ�У�c��OH-��=1.0��10-2mol•L-1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com