
【题目】已知:—CHO+ +H2O,由于醚键比较稳定故利用此反应可保护醛基,也可以合成缩醛类有机物,下列说法中不正确的是( )
+H2O,由于醚键比较稳定故利用此反应可保护醛基,也可以合成缩醛类有机物,下列说法中不正确的是( )
A.保护1mol醛基时也可用![]()
B.合成1mol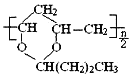 需要1mol
需要1mol![]() 和
和![]()
C.通过上述反应合成的![]() 其核磁共振氢谱中峰面积之比为1:1:1:1:1:2:2:3
其核磁共振氢谱中峰面积之比为1:1:1:1:1:2:2:3
D.![]() 可由
可由![]() 与
与![]() 通过上述反应得到
通过上述反应得到
【答案】B
【解析】
A.由题给信息可知1mol醛基可与2mol羟基反应;
B.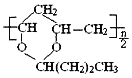 由CH2=CHOH与CH3CH2CH2CHO生成;
由CH2=CHOH与CH3CH2CH2CHO生成;
C.![]() 结构不对称,含有8种H;
结构不对称,含有8种H;
D.由信息可知![]() 对应的反应物之一应含有4个-OH。
对应的反应物之一应含有4个-OH。
A.由题给信息可知1mol醛基可与2mol羟基反应,则保护1mol醛基时也可用2molCH3CH2OH,故A正确;
B. 对应的单体含有C=C键,由nmolCH2=CHOH与0.5nmolCH3CH2CH2CHO生成,故B错误;
对应的单体含有C=C键,由nmolCH2=CHOH与0.5nmolCH3CH2CH2CHO生成,故B错误;
C.![]() 结构不对称,含有8种H,且核磁共振氢谱中峰面积之比为1:1:1:1:1:2:2:3,故C正确;
结构不对称,含有8种H,且核磁共振氢谱中峰面积之比为1:1:1:1:1:2:2:3,故C正确;
D.由信息可知![]() 对应的反应物之一应含有4个-OH,为C(CH2OH)4与
对应的反应物之一应含有4个-OH,为C(CH2OH)4与![]() ,故D正确。
,故D正确。
故选:B。


科目:高中化学 来源: 题型:
【题目】(1)青奥会将于2014年8月在南京举行。青奥会建筑设施使用了大量节能材料,体现了“绿色青奥”的理念。
①用于青奥村工程的隔热保温材料聚氨酯属于______(填字母)。
a.有机高分子材料 b.无机非金属材料 c.金属材料
②青奥中心外墙的复合保温材料采用铝合金锁边。有关铝合金的性质正确的是___(填字母)。
a.强度小 b.耐腐蚀 c.密度大
③青奥会议中心双塔采用了玻璃幕墙设计。制造玻璃的主要原料为纯碱、石灰石和___(填字母)。
a.金刚砂 b.石英 c.水玻璃
(2)如图为某品牌酱油标签的一部分。

①氨基酸态氮的含量是酱油质量的重要指标,这些氨基酸是由大豆中的主要营养物质_____水解而来的。
②配料清单中属于防腐剂的是______。
③小麦中的主要营养物质是_____,写出这种物质完全水解的化学方式:______。
(3)A、B、C三个城市全年雨水的月平均pH变化如图所示。
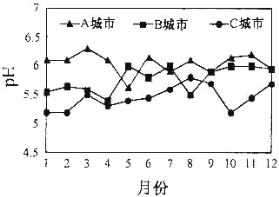
①受酸雨危害最严重的是____城市。
②导致硫酸型酸雨形成主要气体是___,减少燃煤过程产生该气体的措施有_________。
③汽车尾气中含有NO2、NO、CO等有害气体。写出由NO2形成硝酸型酸雨的化学方程式:______;汽车安装尾气净化装置可将NO、CO转化为无害气体,写出该反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题
(1)我国规定生活用水中镉排放的最大允许浓度为0.005 mg/L。处理含镉废水可采用化学沉淀法。试回答下列问题:
①磷酸镉(Cd3(PO4)2)沉淀溶解平衡常数的表达式Ksp=_____________________。
②在某含镉废水中加人Na2S,当S2-浓度达到7.9 × 10-8mol/L时,水体中Cd2+浓度为_____mol/L(已知:Ksp(CdS)=7.9 × 10-27,Cd的相对原子质量:112);此时是否符合水源标准?______(填“是”或“否”)。
(2)炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。制取氯化锌主要工艺如下:
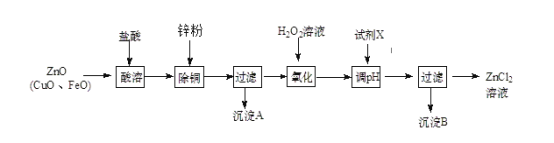
下表列出了相关金属离子生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
金属离子 | Fe3+ | Zn2+ | Fe2+ |
开始沉淀的pH | 1. 1 | 5. 2 | 5. 8 |
沉淀完全的pH | 3. 2 | 6. 4 | 8. 8 |
①加入H2O2溶液的作用是________________。
②流程图中,调节pH时,加入的试剂X可以是________(填序号);
a、ZnO b、NaOH c、Zn2(OH)2CO3 d、ZnSO4
pH应调整到______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去杂质,从而得到纯净的NaNO3晶体,相应的实验流程如图所示。

请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X____。
(2)上述实验流程中①②③步均要进行的实验操作是____(填操作名称)。
(3)上述实验流程中加入过量Na2CO3溶液的目的是____________。
(4)按此实验方案得到的溶液3中肯定含有杂质。为了解决这个问题,可以向溶液3中加入适量的________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡(SnCl4)常用于染色的媒染剂等,工业上常用氯气与金属锡反应制备四氯化锡,某研究性学习小组在实验室用以下装置模拟四氯化锡的制备(夹持装置略)。

已知:①金属锡熔点为231℃,化学活泼性与铁相似。
②SnCl4为无色液体,熔点-33℃,沸点114℃,极易水解生成SnO2·xH2O,在潮湿的空气中发烟。
③SnCl2中的Sn2+易被氧化为Sn4+。
请回答下列问题:
(1)仪器F的名称是_______________,装置B中的试剂是_____________(填名称)。
(2)实验前应先点燃_________(填“A”或“E”)处的酒精灯,待__________(填实验现象)后,再点燃另外一处的酒精灯。
(3)若没有装置C(其他均相同),则D中发生的主要副反应的化学方程式为__________。
(4)该实验装置存在设计缺陷,你的改进措施为______________________________。
(5)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):取0.7500g锡粉溶于足量稀盐酸中,向生成的SnCl2溶液中加入过量的FeCl3溶液,用物质的量浓度为0.1000molL-1 K2Cr2O7标准溶液滴定生成的Fe2+(已知酸性环境下Cr2O72-可被还原为Cr3+),共用去K2Cr2O7溶液的体积为20.00mL。
①锡粒中锡的质量分数_____。
②若溶解锡粉的过程生成的SnCl2溶液中含有Sn![]() ,则测定结果将__________(填“偏高”、“偏低”或“无影响”)
,则测定结果将__________(填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸奥布卡因临床主要用作眼科表面麻醉用药,我国科研人员最近报道了盐酸奥布卡因新的合成路线:
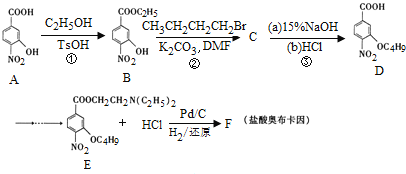
(1)A中含有的官能团名称是 ______ ;A→B的反应类型为 ______ ;
(2)步骤①③的目的是 ______ ;
(3)写出②的化学方程式 ______ ;
(4)G是A的同分异构体,具有下列特征:①苯环上连有硝基和酚羟基,且位于对位;②能发生水解反应,则G的结构有 ______ 种.
(5)下列说法正确的是 ______ ;
a.1molA最多可与含1molNaOH的烧碱溶液反应
b.步骤②中,K2CO3的作用是与生成的HBr反应,使平衡正向移动,提高产率
c.CH3CH2CH2Br系统命名为4-溴丁烷
d.E→F是将-NO2还原为-NH2.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,将33.6LHCl气体溶于50mL水再配成500mL溶液,求:
(1)所得盐酸的物质的量浓度为___________________。
(2)若将此溶液再加水稀释至1.5L,则稀释后盐酸的物质的量浓度为__________。
(3)将(2)的溶液取出1L与足量的石灰石反应,产生的CO2在标准状况下的体积为___________?(此问写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室进行氨溶于水的“喷泉实验”的装置,下列叙述不正确的是( )

A.该实验说明氨气是一种极易溶于水的气体
B.进入烧瓶中的液体颜色由无色变为红色,说明氨水有碱性
C.氨水很稳定,将烧瓶中的红色溶液加热,颜色不会发生变化
D.形成“喷泉”的主要原因是氨气溶于水后,烧瓶内的气压小于大气压
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铵是一种常用的化肥,其工业生产流程如图,请回答下列问题。
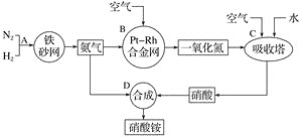
(1)写出反应容器B中发生反应的化学方程式:____。
(2)吸收塔C中通入空气的目的是___;C、D两个反应容器中发生的反应,属于氧化还原反应的是___(填反应容器代号)。
(3)浓硝酸一般保存在棕色试剂瓶里,并放置在阴凉处,用化学方程式解释原因:___。
(4)碳与浓硝酸反应的化学方程式是_____。
(5)将128g铜置于一定量的浓硝酸中并微热。当铜片完全消失时,共收集到NO2和NO的混合气体44.8L(标准状况)。
①写出上述过程中,有关反应的离子方程式:____、____。
②完成该反应至少需要量取10mol·L-1的浓硝酸_____mL。
③混合气体中NO2的体积为____L,NO的体积为____L(均为标准状况下)。
④将收集上述气体的容器倒扣在盛有水的水槽中,并向其中缓慢通入O2使其充分反应,若要使溶液恰好充满容器,则理论上需要参加反应的O2的物质的量为____mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com