
【题目】N2O5是一种新型硝化剂,一定温度下发生2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0,T1温度下的部分实验数据为
4NO2(g)+O2(g) ΔH>0,T1温度下的部分实验数据为
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是( )
A. 500 s内N2O5分解速率为2.96×10-3 mol/(L·s)
B. T1温度下的平衡常数为K1=125,1 000 s时转化率为50%
C. 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2
【答案】C
【解析】试题分析:A.500s内N2O5的浓度变化量为5mol/L-3.52mol/L=1.48mol/L,故N2O5分解速率为![]() =2.96×10-3mol/(Ls),故A正确;B.1000s、1500s时,N2O5的浓度都是2.5mol/L,说明1000s时反应到达平衡,则:
=2.96×10-3mol/(Ls),故A正确;B.1000s、1500s时,N2O5的浓度都是2.5mol/L,说明1000s时反应到达平衡,则:
2N2O5(g)![]() 4NO2(g)+O2(g)
4NO2(g)+O2(g)
开始(mol/L):5 0 0
变化(mol/L):2.5 5 1.25
平衡(mol/L):2.5 5 1.25
故该温度下,平衡常数k=![]() =125,N2O5的转化率=
=125,N2O5的转化率=![]() ×100%=50%,故B正确;C.其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,浓度大于2.5mol/L,平衡向逆反应方向移动,正反应为吸热反应,应为降低温度,故T1>T2,故C错误;D.平衡常数只受温度影响,T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若K1>K2,说明T2温度与T1温度相比,平衡向逆反应方向移动,正反应为吸热反应,应降低温度,则T1>T2,故D正确;故选C。
×100%=50%,故B正确;C.其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,浓度大于2.5mol/L,平衡向逆反应方向移动,正反应为吸热反应,应为降低温度,故T1>T2,故C错误;D.平衡常数只受温度影响,T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若K1>K2,说明T2温度与T1温度相比,平衡向逆反应方向移动,正反应为吸热反应,应降低温度,则T1>T2,故D正确;故选C。


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
【题目】一种新型的乙醇电池(DEFC)是用磺酸类质子溶剂作电解质,在 200℃左右时供电( 如 下 图 所 示 ), 比 甲 醇 电 池 效 率 高 出 32 倍 , 且 比 较 安 全 。 电 池 总 反 应 为C2H5OH+3O2==2CO2+3H2O。则下列说法正确的是( )
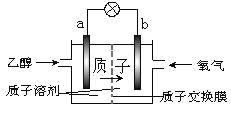
A.a 极为电池的正极
B.电池正极的电极反应:O2 + 4H+ + 4e- = 2H2O
C.电池工作时电子由 b 极沿导线经灯泡再到 a 极
D.溶液中 H+ 向 a 电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A. 该溶液的pH=4 B. 升高温度,溶液的pH增大 C. 此酸的电离平衡常数约为1×10-7 D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(A)=0.5mol/(L·min)B.v(D)=1mol/(L·min)
C.v(C)=0.8mol/(L·min)D.v(B)=0.3mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中的氮氧化物![]() 、
、![]() 、
、![]() 等的含量高低是衡量空气质量优劣的重要指标,对其研究和综合治理具有重要意义。
等的含量高低是衡量空气质量优劣的重要指标,对其研究和综合治理具有重要意义。
![]() 汽车发动机工作时会引发反应:
汽车发动机工作时会引发反应:![]() ,
,![]() ,其能量变化示意图如下:
,其能量变化示意图如下:
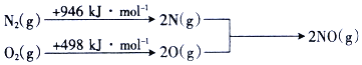
则NO中氮氧键的键能为______![]() 。
。
![]() 以碱液为电解质可实现如下转化:
以碱液为电解质可实现如下转化:![]()
![]()
![]() ,
,![]() 该反应在一定条件下能自发进行的原因是______,阴极反应式为______。
该反应在一定条件下能自发进行的原因是______,阴极反应式为______。
![]() 将
将![]() 和
和![]() 溶于水可得到相应的酸
溶于水可得到相应的酸![]() 时,两种酸的电离平衡常数如表:
时,两种酸的电离平衡常数如表:
|
| |
|
|
|
|
|
|
①![]() 的水解平衡常数为______。
的水解平衡常数为______。
②![]() 溶液和
溶液和![]() 溶液反应的离子方程式为______。
溶液反应的离子方程式为______。
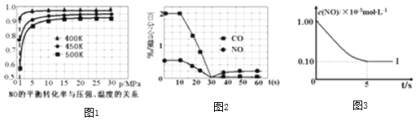
![]() 汽车尾气处理催化装置中涉及的反应之一为:
汽车尾气处理催化装置中涉及的反应之一为:![]() ,
,![]() 研究表明,在使用等质量的催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某科研小组设计了以下三组实验:
研究表明,在使用等质量的催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某科研小组设计了以下三组实验:
实验 编号 |
| NO初始浓度 | CO初始浓度 | 催化剂比表面积 |
Ⅰ | 400 |
|
| 82 |
Ⅱ | 400 |
|
| 124 |
Ⅲ | 450 |
|
| 124 |
根据下列坐标图,计算前5s内用![]() 表示的反应速率为______;并在坐标图中画出上表实验Ⅱ、Ⅲ条件下,混合气体中NO浓度随时间变化的趋势
表示的反应速率为______;并在坐标图中画出上表实验Ⅱ、Ⅲ条件下,混合气体中NO浓度随时间变化的趋势![]() 标明各条曲线的实验编号
标明各条曲线的实验编号![]() 。______
。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是
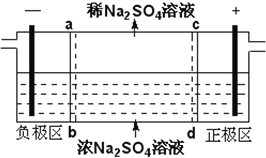
A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.10 mol·L-1标准NaOH溶液滴定某浓度的盐酸。记录数据如下:
实验 序号 | 待测液 体积/mL | 所消耗NaOH标准液的体积/mL | |
滴定前读数/mL | 滴定后读数/mL | ||
1 | 20.00 | 0.50 | 20.54 |
2 | 20.00 | 6.00 | 26.00 |
3 | 20.00 | 1.40 | 21.36 |

(1)滴定时选用酚酞试液作指示剂,如何判断滴定达到终点____________。
(2)滴定过程中,眼睛应注视_____________________;
(3)盐酸的物质的量浓度为___________。
(4)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是__________(填“偏高”“偏低”或“无影响”)。
(5)某同学用已知准确浓度的高锰酸钾溶液滴定溶液中Fe2+的浓度,高锰酸钾溶液应盛放在________(填“甲”或“乙”)中,该反应的离子方程式为_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是二苯乙炔类液晶材料的一种,最简单的二苯乙炔类化合物是![]() 。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:

回答下列问题:
(1)A的结构简式为_______。
(2)D分子中最多有_____个碳原子共平面,与D化学式相同且符合下列条件的同分异构体有__种。(①与D具有相同的官能团,②苯环上的三元取代物)
(3)①的反应类型是________。
(4)⑤的化学方程式为________。
(5)参照上述合成路线,设计一条由苯乙烯和甲苯为起始原料制备![]() 的合成路线:______________。
的合成路线:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏加德罗常数的值,下列说法正确的是
A. 3gCO2中含有的质子数为1.5NA
B. 1L0.1mol·L-1 Na2SiO3溶液中含有的SiO32-数目为0.1NA
C. 0.1molH2O2分解产生O2时,转移的电子数为0.2NA
D. 2.8g聚乙烯中含有的碳碳双键数目为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com