下列分子,中心原子的杂化类型和分子的极性均与乙烯C2H4相同的是( )
A.BCl3
B.H2O
C.CH4
D.SO2
【答案】
分析:根据分子的组成判断形成的δ键数目以及孤电子对数目,以此判断杂化类型,C
2H
4中C形成3个δ键,无孤电子对,为sp
2杂化,为非极性分子,并依此判断分子的立体构型,并判断分子的极性.
解答:解:A.BCl
3中B形成3个δ键,为为sp
2杂化,无孤电子对,为平面三角形分子,为为非极性分子,故A正确;
B.H
2O中O形成2个δ键,孤电子对数=
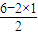
=2,为sp
3杂化,分子为V形,为极性分子,故B错误;
C.CH
4中C形成4个δ键,无孤电子对,为sp
3杂化,为正四面体结构,为非极性分子,故C错误;
D.SO
2中S形成2个δ键,孤电子对数=
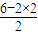
=1,为sp
2杂化,分子为V形,为极性分子,故D错误.
故选A.
点评:本题考查杂化类型以及分子极性的判断,题目难度中等,本题注意把握杂化类型的判断方法,如分子结构对称,则应为非极性分子.

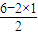 =2,为sp3杂化,分子为V形,为极性分子,故B错误;
=2,为sp3杂化,分子为V形,为极性分子,故B错误;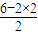 =1,为sp2杂化,分子为V形,为极性分子,故D错误.
=1,为sp2杂化,分子为V形,为极性分子,故D错误.

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案