
”¾ĢāÄæ”æ[»Æѧ-Ń”ŠŽ2£ŗ»ÆѧÓė¼¼Źõ]
Ė«ŃõĖ®ŹĒŅ»ÖÖÖŲŅŖµÄŃõ»Æ¼Į”¢ĘÆ°×¼ĮŗĶĻū¶¾¼Į”£Éś²śĖ«ŃõĖ®³£²ÉÓĆŻģõ«·Ø£¬Ęä·“Ó¦ŌĄķŗĶÉś²śĮ÷³ĢČēĶ¼ĖłŹ¾£ŗ


A£®Ēā»ÆøŖ | B£®¹żĀĖĘ÷ | C£®Ńõ»ÆĖž | D£®ŻĶČ”ĖžE.¾»»ÆĖžF.¹¤×÷ŅŗŌŁÉś×°ÖĆG.¹¤×÷ŅŗÅäÖĘ×°ÖĆ |
Éś²ś¹ż³ĢÖŠ£¬°ŃŅŅ»łŻģõ«ČÜÓŚÓŠ»śČܼĮÅäÖĘ³É¹¤×÷Ņŗ£¬ŌŚŅ»¶ØµÄĪĀ¶Č”¢Ń¹Į¦ŗĶ“߻ƼĮ×÷ÓĆĻĀ½ųŠŠĒā»Æ£¬ŌŁ¾Ńõ»Æ”¢ŻĶČ””¢¾»»ÆµČ¹¤ŅÕµĆµ½Ė«ŃõĖ®”£»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Żģõ«·ØÖʱøĖ«ŃõĖ®ĄķĀŪÉĻĻūŗĵÄŌĮĻŹĒ_______£¬Ń»·Ź¹ÓƵÄ|ŌĮĻŹĒ______£¬ÅäÖĘ¹¤×÷ŅŗŹ±²ÉÓĆÓŠ»śČܼĮ¶ų²»²ÉÓĆĖ®µÄŌŅņŹĒ______”£
£Ø2£©Ēā»ÆøŖAÖŠ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ_______£¬½ųČėŃõ»ÆĖžCµÄ·“Ó¦»ģŗĻŅŗÖŠµÄÖ÷ŅŖČÜÖŹĪŖ_______”£
£Ø3£©ŻĶČ”ĖžDÖŠµÄŻĶČ”¼ĮŹĒ____£¬Ń”ŌńĘä×÷ŻĶČ”¼ĮµÄŌŅņŹĒ______”£
£Ø4£©¹¤×÷ŅŗŌŁÉś×°ÖĆFÖŠŅŖ³ż¾»²ŠĮōµÄH2O2£¬ŌŅņŹĒ______”£
£Ø5£©Ė«ŃõĖ®ÅضČæÉŌŚĖįŠŌĢõ¼žĻĀÓĆKMnO4ČÜŅŗ²ā¶Ø£¬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ_______”£Ņ»ÖÖĖ«ŃõĖ®µÄÖŹĮæ·ÖŹżĪŖ27.5%£¬£ØĆܶČĪŖ1.10g”¤cm3£©£¬ĘäÅضČĪŖ______mol/L”£
”¾“š°ø”æ£Ø1£©ĒāĘųŗĶŃõĘų ŅŅ»łŻģõ« ŅŅ»łŻģõ«£ØŅŅ»łĒāŻģõ«£©²»ČÜÓŚĖ®£¬Ņ×ČÜÓŚÓŠ»śČܼĮ
£Ø2£©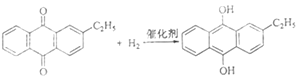 ŅŅ»łĒāŻģõ«
ŅŅ»łĒāŻģõ«
£Ø3£©Ė® H2O2ČÜÓŚĖ®±»Ė®ŻĶČ”£¬ŅŅ»łŻģõ«²»ČÜÓŚĖ®
£Ø4£©H2O2·Ö½ā·Å³öŃõĘų£¬ÓėĒāĘų»ģŗĻ£¬Ņ×·¢Éś±¬ÕØ
£Ø5£©6H++5H2O2+2MnO4-=2Mn2++5O2”ü+8H2O £»8.9
”¾½āĪö”æ
ŹŌĢā£Ø1£©øł¾Ż·“Ó¦ŌĄķ£¬Į½Ź½Ļą¼Ó£¬ŅŅ»łŻģõ«×÷“߻ƼĮ£¬Ź¹H2£«O2=H2O2£¬Ņņ“ĖĄķĀŪÉĻĻūŗĵÄŌĮĻŹĒĒāĘųŗĶŃõĘų£¬Ń»·Ź¹ÓĆŌĮĻŹĒŅŅ»łŻģõ«£¬øł¾ŻĢāŅā£¬ŅŅ»łŻģõ«²»ČÜÓŚĖ®£¬Ņ×ČÜÓŚÓŠ»śČܼĮ£»£Ø2£©Ēā»ÆøŖA£¬·¢ÉśµÄ·“Ó¦ŹĒŅŅ»łŻģõ«ŗĶĒāĘųµÄ·“Ó¦£¬Ņņ“Ė·“Ó¦·½³ĢŹ½ĪŖ£ŗ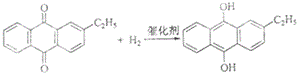 £¬Ńõ»ÆĖžCÖŠ·¢Éś·“Ó¦ŹĒŅŅ»łĒāŻģõ«ŗĶŃõĘųµÄ·“Ó¦£¬Ņņ“Ė»ģŗĻŅŗÖŠµÄÖ÷ŅŖČÜÖŹĪŖŅŅ»łĒāŻģõ«£»£Ø3£©¹żŃõ»ÆĒāŅ×ČÜÓŚĖ®£¬ŅŅ»łŻģõ«²»ČÜÓŚĖ®£¬Ņņ“ĖÓĆĖ®½ųŠŠŻĶČ”£»£Ø4£©¹żŃõ»ÆĒā²»ĪČ¶Ø£¬Ņ×·Ö½ā³ÉŃõĘų£¬ĒāĘųÓėŃõĘų»ģŗĻŅ×·¢Éś±¬ÕØ£»£Ø5£©H2O2¼ČÓŠŃõ»ÆŠŌÓÖÓŠ»¹ŌŠŌ£¬øßĆĢĖį¼ŲČÜŅŗµÄŃõ»ÆŠŌ°ŃH2O2Ńõ»Æ³ÉŃõĘų£¬øł¾Ż»ÆŗĻ¼ŪÅäĘ½·Ø½ųŠŠÅäĘ½£¬Ņņ“Ė·“Ó¦·½³ĢŹ½ĪŖ£ŗH2O2£«6H£«£«2MnO4£=2Mn2£«£«8H2O£«5O2”ü£¬øł¾Żc=1000¦Ńw%/M£¬“śČėŹżÖµ£¬µĆ³öc=8.9mol”¤L£1”£
£¬Ńõ»ÆĖžCÖŠ·¢Éś·“Ó¦ŹĒŅŅ»łĒāŻģõ«ŗĶŃõĘųµÄ·“Ó¦£¬Ņņ“Ė»ģŗĻŅŗÖŠµÄÖ÷ŅŖČÜÖŹĪŖŅŅ»łĒāŻģõ«£»£Ø3£©¹żŃõ»ÆĒāŅ×ČÜÓŚĖ®£¬ŅŅ»łŻģõ«²»ČÜÓŚĖ®£¬Ņņ“ĖÓĆĖ®½ųŠŠŻĶČ”£»£Ø4£©¹żŃõ»ÆĒā²»ĪČ¶Ø£¬Ņ×·Ö½ā³ÉŃõĘų£¬ĒāĘųÓėŃõĘų»ģŗĻŅ×·¢Éś±¬ÕØ£»£Ø5£©H2O2¼ČÓŠŃõ»ÆŠŌÓÖÓŠ»¹ŌŠŌ£¬øßĆĢĖį¼ŲČÜŅŗµÄŃõ»ÆŠŌ°ŃH2O2Ńõ»Æ³ÉŃõĘų£¬øł¾Ż»ÆŗĻ¼ŪÅäĘ½·Ø½ųŠŠÅäĘ½£¬Ņņ“Ė·“Ó¦·½³ĢŹ½ĪŖ£ŗH2O2£«6H£«£«2MnO4£=2Mn2£«£«8H2O£«5O2”ü£¬øł¾Żc=1000¦Ńw%/M£¬“śČėŹżÖµ£¬µĆ³öc=8.9mol”¤L£1”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹÖŠ¾łĪŖ»ÆŗĻĪļµÄŅ»×éŹĒ
A.½šøÕŹÆ”¢øɱł”¢SO2
B.KCl”¢ŃĪĖį”¢NaOH
C.CuSO4”¤5H2O”¢±ł”¢AgCl
D.Ņŗ°±”¢CaCO3”¢ĀĮŗĻ½š
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČēĶ¼ĪŖŹµŃéŹŅijÅØĮņĖįŹŌ¼ĮĘæ±źĒ©ÉĻµÄÓŠ¹ŲŹż¾Ż£¬øł¾Ż±źĒ©ÉĻµÄŹż¾Ż»Ų“šĻĀĮŠĪŹĢā£ŗ

£Ø1£©Č”ČĪŅāĢå»żµÄøĆÅØĮņĖįŹ±£¬ĻĀĮŠĪļĄķĮæ»įĖęĖłČ”Ģå»żµÄ¶ąÉŁ¶ų·¢Éś±ä»ÆµÄŹĒ________£ØŃ”ĢīĻąÓ¦×ÖÄø±ąŗÅ£©
A£®ČÜŅŗĆÜ¶Č B£®ČÜŅŗµÄĪļÖŹµÄĮæÅضČ
C£®ČÜŅŗµÄÖŹĮæ·ÖŹż D£®ČÜÖŹµÄĪļÖŹµÄĮæ
£Ø2£©Ä³Ń§ÉśÓūÓĆÉĻŹöÅØĮņĖįŗĶÕōĮóĖ®ÅäÖĘ450mLĪļÖŹµÄĮæÅضČĪŖ1.0mol”¤L-1µÄĻ”ĮņĖį”£
¢ŁøĆѧɜŠčŅŖÓĆĮæĶ²ĮæČ”________mLÉĻŹöÅØĮņĖį½ųŠŠÅäÖĘ”£
¢ŚøĆŹµŃéÖŠ³żĮĖĮæĶ²”¢²£Į§°ōŗĶÉÕ±Ķā£¬»¹Č±ÉŁµÄ²£Į§ŅĒĘ÷ÓŠ_________”£
¢ŪŌŚÅäÖĘ¹ż³ĢÖŠ£¬ĻĀĮŠŹµŃé²Ł×÷¶ŌĖłÅäÖʵÄĻ”ĮņĖįµÄĪļÖŹµÄĮæÅضČÓŠŗĪÓ°Ļģ£æ£ØŌŚŗóĆęŗįĻßŃ”ŌńĢīŠ“ĻąÓ¦×ÖÄø±źŗÅA”¢Ę«øߣ»B”¢Ę«µĶ£»C”¢ĪŽÓ°Ļģ£©
I”¢ÓĆĮæĶ²ĮæČ”ÅØĮņĖįŹ±ŃöŹÓ°¼ŅŗĆę¶ĮŹż_________
II”¢×ŖŅĘŹ±ČŻĮæĘæÖŠŅŃ¾ÓŠÉŁĮæÕōĮóĖ®________
¢ó”¢¶ØČŻŹ±ŃöŹÓæĢ¶ČĻß__________
¢ō”¢¶ØČŻŗó¾Õńµ“”¢Ņ”ŌČ”¢¾²ÖĆ£¬·¢ĻÖŅŗĆęĻĀ½µ£¬ŌŁ¼ÓŹŹĮæµÄÕōĮóĖ®__________
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖĀČ»ÆĒā¼«Ņ×ČÜÓŚĖ®£¬±ź×¼×“æöĻĀ£¬1Ģå»żµÄĖ®æÉŅŌČܽā500Ģå»żµÄĀČ»ÆĒā£ØHCl£©ĘųĢ壬ĀČ»ÆĒāµÄĖ®ČÜŅŗ¼“ĪŖŃĪĖį”£
ŹµŃéŹŅĻÖÓŠÖŹĮæ·ÖŹżĪŖ36.5%”¢ĆܶČĪŖ1.19gcm©3µÄÅØŃĪĖį£¬ČōÓĆøĆÅØŃĪĖįÅäÖĘ0.4molL©1µÄĻ”ŃĪĖį220mL£¬ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ÅäÖĘøĆĻ”ŃĪĖįŹ±£¬Ó¦Ń”ÓƵÄČŻĮæĘæµÄČŻ»żĪŖ£Ø______£©£®
A. 100mL B. 220mL C. 250mL D. 500mL
£Ø2£©¼ĘĖćŠčŅŖ____mLµÄÅØŃĪĖį£¬
£Ø3£©ŌŚĮæČ”ÅØŃĪĖįŗ󣬽ųŠŠĮĖĻĀĮŠ²Ł×÷£ŗ
¢Ł“żĻ”ŹĶŃĪĖįµÄĪĀ¶ČÓėŹŅĪĀŅ»ÖĀŗó£¬ŃŲ²£Į§°ō×¢ČėČŻĮæĘæÖŠ£®
¢ŚĶłČŻĮæĘæÖŠ¼ÓÕōĮóĖ®ÖĮŅŗĆęĄėČŻĮæĘææĢ¶ČĻß1”«2cmŹ±£¬øÄÓĆ½ŗĶ·µĪ¹Ü¼ÓÕōĮóĖ®£¬Ź¹ČÜŅŗµÄŅŗĆęÓėĘæ¾±µÄæĢ¶Č±źĻßĻąĒŠ£®
¢ŪŌŚŹ¢ÕōĮóĖ®µÄÉձ֊עČėŃĪĖį£¬²¢ÓĆ²£Į§°ō½Į¶Æ£¬Ź¹Ęä»ģŗĻ¾łŌČ£®
¢ÜÓĆÕōĮóĖ®Ļ“µÓÉÕ±ŗĶ²£Į§°ō2ÖĮ3“Ī£¬²¢½«Ļ“µÓŅŗČ«²æ×¢ČėČŻĮæĘ森
ÉĻŹö²Ł×÷ÖŠ£¬ÕżČ·µÄĖ³ŠņŹĒ£ØĢīŠņŗÅ£©_____________”£
£Ø4£©ŌŚĻĀŹöÅäÖĘ¹ż³ĢÖŠ£¬ÅäÖʵÄĻ”ŃĪĖįÅØ¶Č½«»įĘ«øߵďĒ_________________£»Ź¹ÅØ¶Č»įĘ«µĶµÄŹĒ _________________________”££ØĢīŠņŗÅ£©
¢ŁĪ“×ŖŅĘČÜŅŗĒ°ČŻĮæĘæÖŠÓŠÉŁĮæµÄÕōĮóĖ®
¢ŚĮæČ”ÅØŃĪĖįŹ±ø©ŹÓæĢ¶ČĻß
¢ŪĮæČ”ÅØŃĪĖįŗóÓĆÕōĮóĖ®Ļ“µÓĮæĶ²
¢ÜČōĪ“ÓĆÕōĮóĖ®Ļ“µÓÉÕ±ÄŚ±Ś»ņĪ“½«Ļ“µÓŅŗ×¢ČėČŻĮæĘæ
¢Ż¶ØČŻŹ±ø©ŹÓæĢ¶ČĻß
£Ø5£©ŌŚ±ź×¼×“æöĻĀ£¬ÓĆŅ»Ö§ŹÕ¼ÆĀśHClĘųĢåµÄŹŌ¹Üµ¹Į¢ŌŚĖ®²ŪÖŠ£¬Ė®µ¹Īüµ±³äĀśŹŌ¹ÜŹ±ÓĆČū×Ó¶Ā×”ŹŌ¹ÜæŚŹśĮ¢£Ø¼ŁÉčČÜŅŗ²»Š¹Ā©£©£¬ŌņøĆČÜŅŗµÄČÜÖŹµÄĪļÖŹµÄĮæÅضČĪŖ_________________(±£ĮōĮ½Ī»Š”Źż£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŹµŃéŹŅÓĆĆܶČĪŖ1.84 g/cm3”¢ČÜÖŹµÄÖŹĮæ·ÖŹżĪŖ98 %µÄĮņĖį£¬ÅäÖĘ250 mLĪļÖŹµÄĮæÅضČĪŖ0.46 mol/LµÄĮņĖį”£
(1)98 %µÄÅØĮņĖįµÄĪļÖŹµÄĮæÅضČĪŖ_________”£
(2)ĻÖÓŠĻĀĮŠ¼øÖÖ¹ęøńµÄĮæĶ²£¬Ó¦Ń”ÓĆ______£ØĢīŠņŗÅ£©”£
¢Ł5 mLĮæĶ² ¢Ś10 mLĮæĶ² ¢Ū50 mLĮæĶ² ¢Ü100 mLĮæĶ²
(3)ŹµŃéŠčŅŖŅŌĻĀ²½Öč£ŗ
¢Ł¶ØČŻ¢ŚĮæČ”¢ŪŅ”ŌČ¢ÜĻ“µÓ¢Ż×ŖŅĘ¢ŽĄäČ“¢ß¼ĘĖć¢ą×°Ęæ¢įĻ”ŹĶ½ųŠŠĖ³ŠņĪŖ_______”£
(4)ĻĀĮŠ²Ł×÷Ź¹ĖłÅäČÜŅŗµÄĪļÖŹµÄĮæÅضČĘ«øߵďĒ__________”£
A£®ĶłČŻĮæĘæÖŠ×ŖŅĘČÜŅŗŹ±ÓŠÉŁĮæŅŗĢ彦³ö
B£®Ī“Ļ“µÓĻ”ŹĶÅØH2SO4µÄŠ”ÉÕ±
C£®¶ØČŻŹ±ø©ŹÓæĢ¶ČĻß
D£®Ļ“¾»ČŻĮæĘæĪ“øÉŌļ¼“ÓĆĄ“ÅäÖĘČÜŅŗ
E£®¶ØČŻŗóČūÉĻĘæČū·“ø“Ņ”ŌČ£¬¾²ÖĆŗó£¬ŅŗĆę²»µ½æĢ¶ČĻߣ¬ŌŁ¼ÓĖ®ÖĮæĢ¶ČĻß
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æøł¾ŻČČ»Æѧ·½³ĢŹ½S(l)+O2(g)![]() SO2(g)””¦¤H1=293.23 kJ”¤mol1£¬·ÖĪöĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
SO2(g)””¦¤H1=293.23 kJ”¤mol1£¬·ÖĪöĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. ·“Ó¦S(s)+O2(g)![]() SO2(g)µÄČČŠ§Ó¦Š”ÓŚ¦¤H1
SO2(g)µÄČČŠ§Ó¦Š”ÓŚ¦¤H1
B. ·“Ó¦S(g)+O2(g)![]() SO2(g)µÄČČŠ§Ó¦“óÓŚ¦¤H1
SO2(g)µÄČČŠ§Ó¦“óÓŚ¦¤H1
C. 1 mol SO2(g)µÄÄÜĮæŠ”ÓŚ1 mol S(l)ŗĶ1 mol O2(g)µÄÄÜĮæÖ®ŗĶ
D. 1 mol SO2 (g)µÄÄÜĮæ“óÓŚ1 mol S(l)ŗĶ1 mol O2(g)µÄÄÜĮæÖ®ŗĶ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĒāŃõ»ÆĢś½ŗĢåµÄÖʱøÓėĘäŠŌÖŹ¼ģŃ鏵ŃéČēĻĀ£¬Ēė»Ų“šĻĀĮŠĪŹĢā”£
£Ø1£©Š“³öÖʱøĒāŃõ»ÆĢś½ŗĢåµÄ»Æѧ·½³ĢŹ½_____”£
£Ø2£©ÖʱøŹµŃé²Ł×÷£ŗČ”Ņ»Š”ÉÕ±¼ÓČė25mLÕōĮóĖ®¼ÓČČÖĮ·ŠĢŚ£¬Ļņ·ŠĖ®ÖŠÖšµĪ¼ÓČė1”«2mL____£¬¼ĢŠųÖó·ŠÖĮ___£¬Ķ£Ö¹¼ÓČČ”£
£Ø3£©Ö¤Ć÷ÓŠĒāŃõ»ÆĢś½ŗĢåÉś³ÉµÄŹµŃé²Ł×÷ŹĒ______”£
£Ø4£©ČōȔɣĮæÖĘµĆµÄ½ŗĢå¼ÓČėŹŌ¹ÜÖŠ£¬¼ÓČėĮņĖįļ§ČÜŅŗ£¬ĻÖĻóŹĒ___£¬ÕāÖÖĻÖĻó³ĘĪŖ½ŗĢåµÄ____”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŗ£ŃóÖ²ĪļČēŗ£“ųŗĶŗ£ŌåÖŠŗ¬ÓŠ·įø»µÄµāŌŖĖŲ£¬µāŌŖĖŲŅŌµāĄė×ӵĊĪŹ½“ęŌŚ”£ŹµŃéŹŅĄļ“Óŗ£ŃóÖŠĢįČ”µāµÄĮ÷³ĢČēĻĀ£ŗ
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ØD”ś
ØD”ś![]()
ij»ÆѧŠĖȤŠ”×齫ÉĻŹöĮ÷³Ģ¢Ś”¢¢ŪÉč¼Ę³ÉČēĻĀĶ¼ĖłŹ¾²Ł×÷”£

ŅŃÖŖ¹ż³Ģ¢Ś·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖCl2£«2KI===2KCl£«I2
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Š“³öĢįČ”¹ż³Ģ¢Ł”¢¢ŪÖŠŹµŃé²Ł×÷µÄĆū³Ę£ŗ¢Ł____________£¬¢Ū____________”£
£Ø2£©ŌŚ×ĘÉÕ¹ż³ĢÖŠ£¬Ź¹ÓƵ½µÄŹµŃéŅĒĘ÷ÓŠ¾Ę¾«µĘ”¢____________”¢____________(³żÄąČż½ĒĶā)”£
£Ø3£©FÖŠĻĀ²ćŅŗĢåµÄŃÕÉ«ĪŖ________É«£¬ÉĻ²ćŅŗĢåÖŠČÜÖŹµÄÖ÷ŅŖ³É·ÖĪŖ____________”£
£Ø4£©“ÓFÖŠµĆµ½¹ĢĢ¬µā»¹Šč½ųŠŠµÄ²Ł×÷ŹĒ_______________________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹÖŠ£¬¼Čŗ¬ÓŠĄė×Ó¼üÓÖŗ¬ÓŠ¹²¼Ū¼üµÄŹĒ
A.NaOHB.MgCl2C.H2O2D.H2SO4
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com