
(12分)氨气是一种重要的化工原料,但随着工业化进程的加快,氨气也逐渐变成居室里一种重要的污染性气体。
(1)液氨和水类似,也能发生电离:NH3+NH3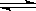 NH4++NH2-,其离子积常数为l.0xl0-30。现将2.3g金属钠投入1.0 L液氨中,则液氨电离平衡____ 移动(填“不”、“正方向”、“逆方向”);待反应结束后,假设溶液的体积不变,所得溶液中NH4+的浓度为____ 。
NH4++NH2-,其离子积常数为l.0xl0-30。现将2.3g金属钠投入1.0 L液氨中,则液氨电离平衡____ 移动(填“不”、“正方向”、“逆方向”);待反应结束后,假设溶液的体积不变,所得溶液中NH4+的浓度为____ 。
(2)实验室模拟工业上用氮气和氢气合成氨气时,在反应前将两种气体通过图装置,该装置的作用有三个
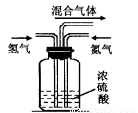
①将氮气和氢气干燥:
②使氮气和氢气充分混合;
③____ ,从而提高氮气和氢气的利用率。
(3)实验室可用氨气通过红热的氧化铜制取氮气,写出该反应的化学方程式:____ 。
(4)家庭空气中的氨主要来自建筑施工中使用的混凝土外加剂,如混凝土防冻剂尿素会和水缓慢发生反应:CO(NH2)2(s)+H2O(g)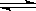 2NH3(g) +CO2(g),该反应的平衡常数表达式为K= 。
2NH3(g) +CO2(g),该反应的平衡常数表达式为K= 。
(5)已知:N2(g)+O2(g)=2NO(g); △H=180Kj·mol-l
4NH3(g)+5O2(g) =4NO(g)+6H2O(g); △H= -908Kj·mol-l
请写出氨气被一氧化氮氧化生成氮气和气态水的热化学方程式: 。
(1)正方向;1.0×l0-29mol/L (2)通过观察气泡控制氮气和氢气的流量,使氮气和氢气的量达到最佳比例;(3)2NH3+3CuO 3Cu+N2+3H2O (4)
3Cu+N2+3H2O (4)
(5)4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=-1808KJ/mol。
【解析】
试题分析:(1)将2.3g金属钠投入1.0L液氨中发生反应为:2Na+2NH3=2NaNH2+H2↑;促进液氨的电离,依据:NH3+NH3=NH4++NH2-,[NH4+][NH2-]=l.0×l0-30;反应生成NH2-物质的量为0.1mol;浓度为0.1mol/L,所得溶液中NH4+的浓度l.0×l0-29mol/L,答案为:正方向;1.0×l0-29mol/L;
(2)该装置的作用有三个将氮气和氢气干燥,使氮气和氢气充分混合,控制氮气和氢气通入的比例和通入的快慢,提高原料的利用率,答案为:通过观察气泡控制氮气和氢气的流量,使氮气和氢气的量达到最佳比例;
(3)用氨气通过红热的氧化铜制取氮气,依据氧化还原反应的化合价升降相同,氧化铜中铜的元素化合价降低生成铜,反应的化学方程式为:2NH3+3CuO 3Cu+N2+3H2O,答案为:2NH3+3CuO
3Cu+N2+3H2O,答案为:2NH3+3CuO 3Cu+N2+3H2O;
3Cu+N2+3H2O;
(4)CO(NH2)2(s)+H2O(g)?2NH3(g)+CO2(g),依据化学平衡,结合平衡常数的计算式列式:平衡常数是用平衡时生成物的浓度幂次方乘积除以反应物的幂次方乘积,得到平衡常数表达式:K= ;
;
(5)①N2(g)+O2(g)=2NO(g);△H=180Kj?mol-l ②4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-908Kj?mol-l氨气被一氧化氮氧化生成氮气和气态水的热化学方程式依据盖斯定律,结合热化学方程式合并计算:①×5+②得到:4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=-1808KJ/mol。
考点:考查影响平衡的因素,平衡常数表达式,热化学方程式的书写。


科目:高中化学 来源:2015届江苏省泰州市姜堰区高二上学期中考试化学试卷(选修)(解析版) 题型:填空题
(12分)T℃时,容积固定为1L的密闭容器甲中充入2molSO2、1molO2,发生反应:2SO2(g) +O2(g)  2SO3(g) △H<0,维持温度为T℃,4min后达到平衡,测得平衡时n(SO3)=1.2mol。
2SO3(g) △H<0,维持温度为T℃,4min后达到平衡,测得平衡时n(SO3)=1.2mol。
(1)T℃时,该反应的平衡常数K的数值为 。
(2)另有容器乙和丙均分别充入2molSO2、1molO2,起始容器容积与甲相同,起始温度均为T℃。在反应过程中乙容器保持温度和压强不变,丙容器保持容器体积不变并与外界绝热,分别建立平衡后:

①三个容器中反应的平衡常数K:K(甲) K(乙) K(丙)(选填“>”、“<”或“=”)。
②达到平衡时,甲、乙、丙三容器中,SO2的转化率α最小的是 容器,混合气体密度ρ最大的是 容器。
(3)若向上述容器甲的平衡体系中继续充入2mol SO2和1mol O2,在相同温度下再次达到平衡后,SO3的物质的量 (填字母)。
a.2.4mol b.大于1.2mol,小于2.4mol c.大于2.4mol
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期第一次阶段性检测化学试卷(解析版) 题型:填空题
(14分)将镁、铝的混合物共0.2 mol, 溶于200 mL 4 mol·L—1的盐酸溶液中,然后再滴加2mol·L—1的NaOH溶液。请回答下列问题:
(1)若在滴加NaOH溶液的过程中,沉淀质量m 随加入NaOH溶液的体积V变化情况如图所示。当V1=160 mL时,则金属粉末中n (Al)= mol;

(2)0~V1段发生的反应的离子方程式为 ;
(3)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+ 刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)= mL;
(4)若镁、铝的混合物仍为0.2 mol,其中镁粉的物质的量分数为a,改用200 mL 4mol·L—1的硫酸溶解此混合物后,再加入840mL 2 mol·L—1的NaOH溶液,所得沉淀中无Al(OH)3,则a的取值范围为 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期第一次阶段性检测化学试卷(解析版) 题型:选择题
足量的两份铝粉分别与等体积的盐酸和NaOH 溶液反应,同温同压下产生的气体体积比为1:1,则盐酸和NaOH溶液的物质的量浓度之比为
A.2:3 B.3:1 C.1:2 D.1:1
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期期中考试化学试卷(解析版) 题型:填空题
(12分)(I)三氧化二铁和氧化亚铜(Cu2O)都是红色粉末.常用作颜料。已知氧化亚铜溶于稀硫酸生成Cu和CuSO4。某校化学实验小组为了探究由Fe2O3和Cu2O组成的混合物中两者物质的量相对大小,某同学认为只要取少量粉末放入足量稀硫酸中,通过观察现象即可。
(1)上述实验过程中发生的反应有(用离子方程式表示):
①Fe2O3+6H+= 2Fe3++3H2O
② ③
(2)若实验中观察到溶液变为蓝色且有固体剩余,则n(Cu2O) n(Fe2O3)。(填“>”、“<”或“=”)。
(II)分别在密闭容器的两个反应室中进行如下反应:
左反应室:A(g)+2B(g)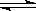 2C(g)
2C(g)
右反应室:2Z(g) X(g)+Y(g)
X(g)+Y(g)
在反应室之间有无摩擦、可自由滑动的密封板隔断。反应开始和达到平衡时有关物理量的变化如下图所示:

(1)A(g)+2B(g) 2C(g) 的△H 0(填“>”、“<”或“=”)。
2C(g) 的△H 0(填“>”、“<”或“=”)。
(2)在平衡(I)和平衡(Ⅱ)中,X的体积分数 (填序号)。
a.一定相等 b.一定不相等 c.可能相等
(3)达到平衡(I)时,A的转化率为 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期期中考试化学试卷(解析版) 题型:选择题
某有机物的结构简式如图所示(未表示出其空间构型)。下列关于该物质的性质描述正确的是
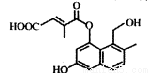
A.能使酸性KMO4溶液褪色
B.能与FeCl3溶液发生显色反应
C.既能发生消去反应,也能发生取代反应
D.1 mol该物质最多可与3mol NaOH反应
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列有关物质的性质与应用不相对应的是
A.SO2具有氧化性,可用于漂白纸浆
B.淀粉溶液遇碘变成蓝色,可用于检验碘单质的存在
C.Fe在常温下遇浓硫酸发生钝化,可用铁制容器盛放冷的浓硫酸
D.Zn具有还原性和导电性,可用作锌锰干电池的负极材料
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
下列实验现象与氧化还原反应无关的是 ( )
A.碳酸钠溶液中加入CaCl2溶液产生白色沉淀物
B.硫酸铜溶液中插入铁片,铁片上出现红色沉淀物
C.向双氧水中加入二氧化锰产生气泡
D.铁在氧气中燃烧,剧烈反应火星四射
查看答案和解析>>
科目:高中化学 来源:2015届江西南昌三中高三11月份月考化学试卷(解析版) 题型:填空题
(8分)如图装置中,容器甲内充入1 mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体。恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时,容器体积缩小至最小,为原体积的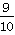 ,随着CO2的继续通入,活塞又逐渐向右移动(不考虑活塞的摩擦)
,随着CO2的继续通入,活塞又逐渐向右移动(不考虑活塞的摩擦)
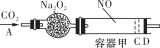
已知当活塞移至C处时,干燥管中物质的质量增加了22.4 g。
(1)当活塞移至C处时,通入标准状况下的CO2气体为_________________L。
(2)当活塞移至C处时,容器甲中NO2转化为N2O4的转化率是多少(注意:本小题要求写出计算过程)?
(3)活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处,则a值必_________0.1(填“大于”、“小于”或“等于”),其理由是_____________________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com