【答案】
分析:SO
2与NaOH作用可能的反应有:SO
2+2NaOH=Na
2SO
3+H
2O;SO
2+NaOH=NaHSO
3.
若1120mLSO
2气体只生成0.05molNa
2SO
3,则Na
2SO
3的质量是0.05mol×126g/mol=6.3g,
若1120mLSO
2气体只生成0.05molNaHSO
3,则NaHSO
3的质量是0.05mol×104g/mol=5.2g,
因为第一份溶液中溶质5.2<5.75<6.3,SO
2过量,含溶质一定含Na
2SO
3和NaHSO
3;
因为第二份溶液中溶质6.3<7.1,NaOH过量,含溶质一定含Na
2SO
3和NaOH.
设第一份溶液中含Na
2SO
3物质的量为x,NaHSO
3物质的量为y,根据二者质量之和为5.75g与硫元素守恒列方程计算x、y的值,再根据Na元素守恒计算n(NaOH),利用c=
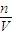
计算;
第二份溶液,利用硫元素守恒计算n(Na
2SO
3),进而计算m(Na
2SO
3),再计算溶液中m(NaOH),再根据Na元素守恒计算原溶液中n(NaOH),利用c=
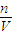
计算.
解答:解:SO
2与NaOH作用可能的反应有:SO
2+2NaOH=Na
2SO
3+H
2O;SO
2+NaOH=NaHSO
3. 1120mLSO
2气体的物质的量为
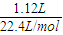
=0.05mol,
若1120mLSO
2气体只生成0.05molNa
2SO
3,则Na
2SO
3的质量是0.05mol×126g/mol=6.3g,
若1120mLSO
2气体只生成0.05molNaHSO
3,则NaHSO
3的质量是0.05mol×104g/mol=5.2g,
因为第一份溶液中溶质5.2<5.75<6.3,SO
2过量,含溶质一定含Na
2SO
3和NaHSO
3;
因为第二份溶液中溶质6.3<7.1,NaOH过量,含溶质一定含Na
2SO
3和NaOH.
设第一份溶液中含Na
2SO
3物质的量为x,NaHSO
3物质的量为y,根据二者质量之和为5.75g与硫元素守恒,则:
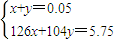
解得:x=0.025mol,y=0.025mol
根据钠元素守恒,原溶液中n(NaOH)=2x+y=0.075mol,
所以原NaOH溶液的物质的量浓度为
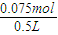
=0.15mol/L,
第二份溶液中含n(Na
2SO
3)=n(SO
2)=0.05mol,质量是6.30g,则含NaOH的质量为:m(NaOH)=7.10g-6.30g=0.80g.
根据钠元素守恒,原溶液中含NaOH物质的量为:2×0.05mol+
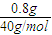
=0.12mol,
所以原溶液中c(NaOH)=
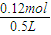
=0.240mol/L,
答:两份NaOH溶液的物质的量浓度分别为0.15mol/L和0.24mol/L.
点评:本题考查混合物的有关计算,难度中等,清楚发生的反应,根据溶质的质量,利用极限假设法确定溶质的成分是解题的关键.

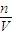 计算;
计算;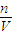 计算.
计算.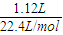 =0.05mol,
=0.05mol,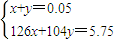
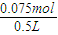 =0.15mol/L,
=0.15mol/L,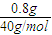 =0.12mol,
=0.12mol,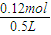 =0.240mol/L,
=0.240mol/L,
