
| A. | 配制5% NaCl溶液时,将已准确称量的NaCl放入烧杯中并加适量的水搅拌溶解 | |
| B. | 配制1mol•L-1 Na0H溶液时,将溶解后的NaOH溶液立即注入容量瓶 | |
| C. | 配制0.1mol•L-1的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释 | |
| D. | 配制1mol•L-1 Na2CO3溶液500mL,将Na2CO3放在托盘天平右盘称量 |
分析 A.配制氯化钠溶液需要计算需要质量,用天平称量,得到固体在水中溶解;
B.容量瓶为精密仪器,不能用来溶解固体;
C.容量瓶为精密仪器,不能用来稀释浓溶液;
D.依据托盘天平称量方法解答.
解答 A.配制溶液时,称量固体放入烧杯中溶解即可得到相应浓度的溶液,故A正确;
B.配制1mol•L-1 Na0H溶液时,不能直在容量瓶中溶解固体,应先在烧杯中溶解,待冷却到室温再转移的到容量瓶,故B错误;
C.配制0.1mol•L-1的H2SO4溶液时,将量取的浓H2SO4放入烧杯稀释,冷却到室温后再转移到容量瓶中,故C错误;
D.使用托盘天平称量固体,应遵循左物右码原则,将Na2CO3放在托盘天平左盘称量,故D错误;
故选:A.
点评 本题考查了一定浓度溶液的配制,明确配制过程及操作方法是解题关键,注意容量瓶的使用方法和注意事项,题目难度不大.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:解答题

| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子数 | B. | 相对分子质量 | C. | 质量 | D. | 密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
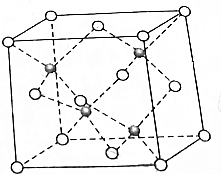 Cu与F形成的化合物的晶胞结构如图所示,若晶体密度为ag•cm-3,则Cu与F最近距离为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×83}{{aN}_{A}}}$×1010 pm.(阿伏加德罗常数用NA表示,列出计算表达式,不用化简:图中○为Cu,
Cu与F形成的化合物的晶胞结构如图所示,若晶体密度为ag•cm-3,则Cu与F最近距离为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×83}{{aN}_{A}}}$×1010 pm.(阿伏加德罗常数用NA表示,列出计算表达式,不用化简:图中○为Cu, 为F)
为F)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
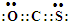 .
.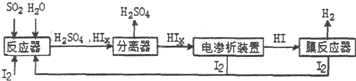
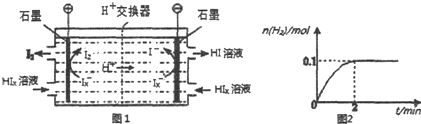
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硫酸钡沉淀中加入浓碳酸钠溶液充分搅拌后,取沉淀(洗净)放入盐酸中有气泡产生,说明Ksp(BaCO3)<Ksp(BaSO4) | |
| B. | 向淀粉溶液中加入稀硫酸并加热片刻,然后再加入适量银氨溶液进行水浴加热,没有银镜生成,说明淀粉没有水解 | |
| C. | 将二氧化硫气体通入到高锰酸钾酸性溶液中,溶液紫红色褪去,说明二氧化硫有漂白性 | |
| D. | 向碳酸钠溶液中滴加几滴酚酞试液,然后再加入氯化钡溶液,溶液红色褪去,说明碳酸钠溶液中存在水解平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
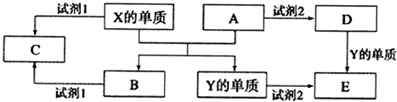
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com