
| A. | (10-8+10-10)mol/L | B. | (10-4+10-6)mol/L | C. | (10-8+10-9)mol/L | D. | 2×10-10mol/L |
分析 两种碱溶液混合,先计算出混合后溶液的c(OH-),再根据溶液的Kw计算出溶液的c(H+),由此分析解答.
解答 解:pH=8的NaOH溶液中c(OH-)=1×10-6mol/L,pH=10的NaOH溶液中c(OH-)=1×10-4mol/L,
混合后c(OH-)=$\frac{1{0}^{-6}+1{0}^{-4}}{2}$mol/L≈$\frac{1{0}^{-4}}{2}$mol/L,
则溶液中的c(H+)=$\frac{Kw}{c(O{H}^{-})}$=$\frac{\frac{1{0}^{-14}}{1{0}^{-4}}}{2}$mol/L=2.0×10-10mol/L,
故选D.
点评 本题考查两种碱溶液混合后的溶液氢离子浓度计算,题目难度不大,注意先计算溶液中c(OH-),再计算c(H+).


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
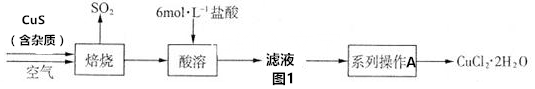

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
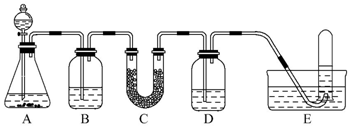
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | 除去CO2中混有的HCl |
| C | ||
| D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镀锡的铁皮,破损后铁皮反而易被腐蚀 | |
| B. | 纯铁比生铁更易被腐蚀 | |
| C. | 金属的电化腐蚀比化学腐蚀普遍 | |
| D. | 金属腐蚀的本质是M-ne-=Mn+而被损耗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3溶于HI溶液中:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 磁性氧化铁溶于稀盐酸:Fe3O4+8H+═Fe3++2Fe2++4H2O | |
| C. | NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| D. | 酸性高锰酸钾溶液和硫酸亚铁溶液反应:MnO4-+3Fe2++4H+═MnO2↓+3Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
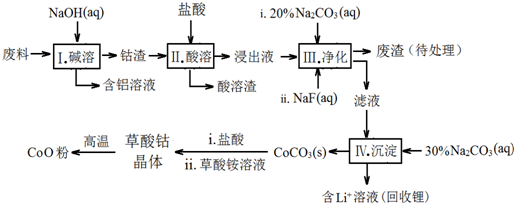
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com