
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SiO2有导电性 | SiO2可用于制备光导纤维 |
| B | Fe3+有氧化性 | FeCl3溶液可溶解废旧电路中的铜 |
| C | NH3有还原性 | NH3可用H2SO4吸收 |
| D | 浓HNO3有酸性 | 浓HNO3不可用贴铁容器盛放 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.SiO2不导电,是制光导纤维的原料;
B.铁离子能够将金属铜氧化成铁离子,据此可以回收废旧电路板中的铜;
C.氨气为碱性气体,硫酸具有酸性,二者能够反应生成硫酸铵;
D.浓硝酸具有强氧化性,能够使铁表明形成一层致密的氧化物保护膜.
解答 解:A.SiO2不导电,二氧化硅是良好的光导材料,所以制光导纤维的原料,Ⅰ不正确、Ⅱ正确,Ⅰ和Ⅱ无因果关系,故A错误;
B.Fe3+具有氧化性,能将铜氧化为为铜离子,所以FeCl3溶液可用于回收废旧电路板中的铜,Ⅰ、Ⅱ正确有因果关系,故B正确;
C.氨气与硫酸反应的原因是氨气为碱性气体,硫酸具有酸性,二者反应生成盐硫酸铵,所以Ⅰ和Ⅱ之间没有因果关系,故C错误;
D.浓硝酸具有强氧化性,能够与铁、铝发生钝化,所以可用贴铁容器盛放浓硝酸,所以Ⅰ、Ⅱ没有因果关系,故D错误;
故选B.
点评 本题考查较为综合,涉及铁盐与亚铁盐的转变、浓硝酸的化学性质、二氧化硅的性质与用途,题目难度不大,明确常见元素及其化合物性质为解答关键,试题培养了学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3mol•L-1 的Na2SO4溶液中含有Na+和SO42-的总物质的量为0.9mol | |
| B. | 当1L水吸收22.4L氨气时所得氨水的浓度不是1mol•L-1,只有当22.4L氨气溶于水制得1L氨水时,其浓度是1mol•L-1 | |
| C. | 在K2SO4和NaCl的混合溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同 | |
| D. | 250g胆矾溶于水得到1L溶液,所得CuSO4溶液的物质的量浓度为1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①②③④ | C. | ①③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H+、Ba2+、Mg2+、Cl- | B. | Cl-、CO32-、Cu2+、Mg2+ | ||
| C. | NO3-、SO42-、K+、H+ | D. | NO3-、OH-、Ba2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、NO3-、MnO4- | B. | K+、Na+、Cl-、SO42- | ||
| C. | K+、Na+、Cl-、Cu2+ | D. | Na+、Ba2+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCl2与BaO2都是既含有离子键又含有共价键的离子化合物 | |
| B. | 16O2和18O2互为同素异形体 | |
| C. | 氯化氢分子的电子式: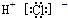 | |
| D. | 质子数为17、中子数为20的氯原子:${\;}_{17}^{37}$Cl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com