
【题目】已知 3.6 g 碳在 6.4 g 的氧气中燃烧,至反应物耗尽,并放出 X kJ 热量。已知单质 C(s)的燃烧热数值为 Y kJ·mol-1,则 1 mol C(s)与 O2(g)反应生成 CO(g)的反应热 ΔH 为( )
A. -Y kJ/mol B. -(10X-Y) kJ/mol C. -(5X-0.5Y) kJ/mol D. +(10X-Y) kJ/mol
【答案】C
【解析】试题分析:碳在氧气中燃烧,氧气不足发生反应2C+O2![]() 2CO,氧气足量发生反应C+O2
2CO,氧气足量发生反应C+O2![]() CO2,3.6g碳的物质的量为3.6g÷12g/mol==0.3mol,6.4g的氧气的物质的量为6.4g÷32g/mol==0.2mol,n(C):n(O2)=3:2,介于2:1与1:1之间,所以上述反应都发生,令生成的CO为xmol,CO2为ymol,根据碳元素守恒有x+y=0.3,根据氧元素守恒有x+2y=0.2×2,联立方程,解得x=0.2,y=0.1,单质碳的燃烧热为Y kJ/mol,所以生成0.1mol二氧化碳放出的热量为0.1mol×Y kJ/mol=0.1YkJ,所以生成0.2molCO放出的热量为XkJ-0.1YkJ,由于碳燃烧为放热反应,所以反应热△H的符号为“-”,故1mol C与O2反应生成CO的反应热△H=-(XkJ-0.1YkJ)÷0.2mol==-(5X-0.5Y)kJmol1,故C项正确。
CO2,3.6g碳的物质的量为3.6g÷12g/mol==0.3mol,6.4g的氧气的物质的量为6.4g÷32g/mol==0.2mol,n(C):n(O2)=3:2,介于2:1与1:1之间,所以上述反应都发生,令生成的CO为xmol,CO2为ymol,根据碳元素守恒有x+y=0.3,根据氧元素守恒有x+2y=0.2×2,联立方程,解得x=0.2,y=0.1,单质碳的燃烧热为Y kJ/mol,所以生成0.1mol二氧化碳放出的热量为0.1mol×Y kJ/mol=0.1YkJ,所以生成0.2molCO放出的热量为XkJ-0.1YkJ,由于碳燃烧为放热反应,所以反应热△H的符号为“-”,故1mol C与O2反应生成CO的反应热△H=-(XkJ-0.1YkJ)÷0.2mol==-(5X-0.5Y)kJmol1,故C项正确。


科目:高中化学 来源: 题型:
【题目】在已达到电离平衡的0.1 mol/L醋酸溶液中,欲使平衡向电离的方向移动,同时使溶液的pH降低,应采取的措施是( )
A.加少量盐酸 B.加热 C.加少量醋酸钠晶体 D.加少量水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用二氧化碳废气生产化工产品是解决室温效应的有效途径之一,对用二氧化碳为主要原料生产的四种产品(如下图所示)的相关说法不正确的是
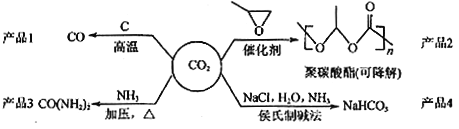
A.反应CO2(g)+C(s)=2CO(g)的△H>0,△S>0
B.用聚碳酸酯代替聚乙烯等传统塑料,可消除白色污染
C.CO(NH2)2与NH4CNO互为同分异构体,两者化学性质相同
D.侯氏制碱法的工艺过程中应用了物质溶解度的差异
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有SO42-、CO32-、Cl-。为了检验其中是否含有SO42-,除BaCl2溶液外,还需要的溶液是( )
A. H2SO4溶液 B. HCl溶液
C. NaOH溶液 D. NaNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关糖类、油脂、蛋白质的叙述正确的是
A. 向淀粉溶液中加入碘水后,溶液变蓝色
B. 蛋白质纤维素、蔗糖、PVC都是高分子化合物
C. 硫酸铜溶液、硫酸铵溶液均可使蛋白质发生变性
D. 变质的油脂有难闻的特味气味,是由于油脂发生了水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑧种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在最高价氧化物的水化物中,酸性最强的化合物的名称是______,碱性最强的化合物的化学式是_______。
(2)⑤⑦形成化合物的电子式___。②形成的最高价氧化物的结构式____。
(3)最高价氧化物是两性氧化物的元素其元素符号是____;写出它的氢氧化物与⑧的最高价氧化物的水化物反应的离子方程式________。
(4)⑥的单质与⑤的最高价氧化物的水化物反应的离子方程式是______。
(5)②和⑦可形成原子数1∶2的液态化合物甲,并能溶解⑦的单质,用电子式表示甲的形成过程:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100 mL BaCl2、AlCl3、FeCl3的混合溶液A中逐滴加入Na2SO4和NaOH的混合溶液B,产生沉淀的物质的量n和加入溶液B的体积关系如下图所示:
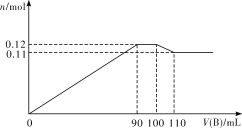
(1)当加入110 mL B溶液时,溶液中的沉淀是___________(填化学式)。
(2)溶液B中Na2SO4和NaOH的物质的量浓度之比是___________。当B溶液加到90 mL~100 mL这一段时间中,所发生的离子反应方程式是____________________。
(3)将A、B溶液中各溶质的物质的量浓度(c)填入下表中。
溶质 | Na2SO4 | NaOH | BaCl2 | AlCl3 | FeCl3 |
c/mol·L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3+5O2=4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列关系正确的是
A. 4v(NH3)=5v(O2) B. 5v(O2)=6v(H2O)
C. 3v(NH3)=2v(H2O) D. 5v(O2)=4v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F六种短周期元素,其中B,C、D、E四种元素在化学反应中均能形成简单的阴、阳离子,且B、C、D离子具有相同的电子层结构。已知:
①A是形成物质种类最多的元素,F和A同主族;
②C的氢化物分子G是具有10电子的微粒,且可以发生下图转化:
![]()
③E和D是同主族元素;
④B和D可形成个数比为1:1和2:1的离子化合物X和Y。
请回答下列问题:
(1)B与D形成离子化合物Y具有漂白性,写出Y的电子式______,该化合物和元素A的最高价氧化物O反应的化学方程式为:__________;一定量的Y与O反应后得到的固体物质,能恰好与含400 mL 2 mol/L的稀盐酸反应,并收集到0.25 mol气体,则该固体物质的组成为________(用物质的量表示)。
(2)G气体的检验方法为_________;13.44 L气体G(标准状况下测定)按照上图转化方式可以获得M物质的量分别为__________mol。
(3)某化学兴趣小组欲采用右图装置证明A、C、F三种元素性质的递变性,其中甲装置中锥形瓶内所加试剂为石灰石:
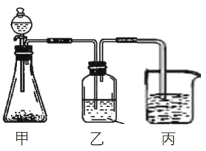
①甲装置中发生反应的离子方程式为________________;
②乙装置中应添加的试剂为______________;
③丙装置中可能发生的实验现象为___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com