
 烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:分析 (1)已知:①NO(g)+O3(g)═NO2(g)+O2(g)△H=-200.9kJ•mol-1
②NO(g)+$\frac{1}{2}$O2(g)═NO2(g)△H=-58.2kJ•mol-1
由盖斯定律可知,①+②×2得3NO(g)+O3(g)=3NO2(g),据此计算;
(2)①根据O3的强氧化性分析;
②SO2与O3的反应速率很慢;
(3)SO32-将NO2转化为NO2-,N元素的化合价降低,则S元素的化合价升高,所以SO32-被氧化为SO42-;
(4)CaSO3水悬浮液中加入Na2SO4溶液,溶液中存在CaSO3+SO42-?CaSO4+SO32-,根据Ks计算;根据CaSO3+SO42-?CaSO4+SO32-的平衡移动影响因素.
解答 解:(1)已知:①NO(g)+O3(g)═NO2(g)+O2(g)△H=-200.9kJ•mol-1
②NO(g)+$\frac{1}{2}$O2(g)═NO2(g)△H=-58.2kJ•mol-1
由盖斯定律可知,①+②×2得3NO(g)+O3(g)=3NO2(g),△H=-317.3kJ/mol;
故答案为:-317.3;
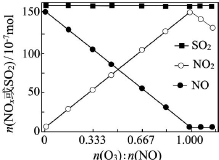
(2)①O3具有强氧化性,当n(O3):n(NO)>1时,过量的O3会将NO2氧化为更高价态的化合物;
故答案为:O3将NO2氧化成更高价氮氧化物;
②SO2具有较强的还原性,增加O3量,SO2的量几乎没有变化,说明SO2与O3的反应速率很慢;
故答案为:SO2与O3的反应速率很慢;
(3)SO32-将NO2转化为NO2-,N元素的化合价降低,则S元素的化合价升高,所以SO32-被氧化为SO42-,其反应的离子方程式为:SO32-+2NO2+2OH-=SO42-+2NO2-+H2O;
故答案为:SO32-+2NO2+2OH-=SO42-+2NO2-+H2O;
(4)CaSO3水悬浮液中加入Na2SO4溶液,溶液中存在CaSO3+SO42-?CaSO4+SO32-,则c(SO32-)=$\frac{Ksp(CaS{O}_{3})}{Ksp(CaS{O}_{4})}×c(S{{O}_{4}}^{2-})$;CaSO3水悬浮液中加入Na2SO4溶液,由CaSO3+SO42-?CaSO4+SO32-可知溶液中SO32-的浓度增大,加快SO32-与NO2的反应速率;
故答案为:CaSO3转化为CaSO4使溶液中SO32-的浓度增大,加快SO32-与NO2的反应速率.
点评 本题考查了盖斯定律的应用、影响反应速率的因素、化学平衡移动、溶度积常数的应用等,题目综合性较强,难度中等,侧重于考查学生对化学原理的应用能力和计算能力.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
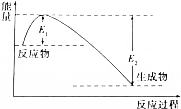 如图所示的是1molNO2和足量的CO完全反应生成CO2和NO过程中的能量变化示意图,能够表示出CO2+NO=NO2+CO的能量变化示意图的是( )
如图所示的是1molNO2和足量的CO完全反应生成CO2和NO过程中的能量变化示意图,能够表示出CO2+NO=NO2+CO的能量变化示意图的是( )| A. |  | B. |  | C. | 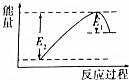 | D. | 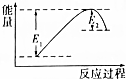 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 1:4 | C. | 1:5 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
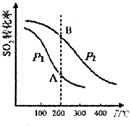 研究硫酸工业原理及含硫化合物的性质具有重要意义.
研究硫酸工业原理及含硫化合物的性质具有重要意义.| 气体 | SO2 | O2 | SO3 |
| 浓度(mol•L-1) | 0.4 | 1.2 | 1.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
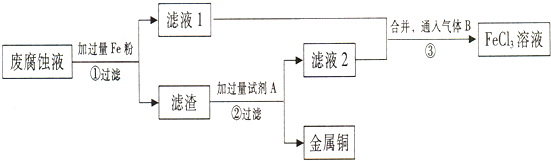
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com