
【题目】按要求回答问题。
(1)羰基硫的水解反应和氢解反应是两种常用的脱硫方法:
水解反应: COS(g)+ H2O(g)![]() H2S(g)+CO2(g) △H=-34kJ/mol
H2S(g)+CO2(g) △H=-34kJ/mol
氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) △H=+7kJ/mol
H2S(g)+CO(g) △H=+7kJ/mol
己知: 2H2(g)+O2(g)=2H2O(g) △H=-484 kJ/mol
写出表示CO燃烧热的热化学方程式:_______________。
(2)碳酸H2CO3,K1=4.3×10-7,K2=5.6×10-11;草酸H2C2O4,K1=5.9×10-2,K2=6.4×10-5; 0.1mol/LNa2CO3溶液的pH_____0.1mol/L Na2C2O4溶液的pH。(选填“大于”、“小于”或“等于”)。若将等分浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是___________。(选填编号)
A.c(H+)>c(HC2O4-)> (HCO3-)>c (CO32-)
B.c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-)
C.c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-)
D.c(H2CO3) >c(HCO3-)>c(HC2O4-)>c(CO32-)
(3)已知:①难溶电解质的溶度积常数:Ksp(CaF2)=1.5×10-10;②25℃时2.0×10-3mol/L氢氟酸水溶液中,调节溶液pH(忽略体长变化),得到c(HF)、c(F-) 与溶液pH 的变化关系,如图所示:
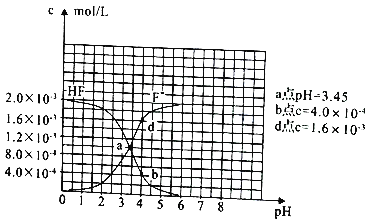
请根据信息回答下列问题:
①25℃时,HF电离平衡常数的数值Ka≈_______。
②4.0×10-3mol/LHF溶液与4.0×10-4mol/LCaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。____________。
【答案】 CO(g)+1/2O2(g)=CO2(g) △H=-283 kJ·mol-l 大于 AC 10-3.45(或3.5×10-4)[当c(F-)=c(HF)时,Ka=c(H+),查图中的交点处即为c(F-)=c(HF),故所对应的pH即为Ka的负对数 当pH=4.0时,溶液中的c(F-)=1.6×10-3mol/L,溶液中c(Ca2+)=2.0×l0-4mol/L,c( Ca2+)×c2(F-)= 5.l×10-10> Ksp( CaF2),有沉淀产生
【解析】(1)已知①COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H1=-34kJ/mol
H2S(g)+CO2(g) △H1=-34kJ/mol
②COS(g)+H2(g)![]() H2S(g)+CO(g) △H2=+7kJ/mol
H2S(g)+CO(g) △H2=+7kJ/mol
③2H2(g)+O2(g)=2H2O(g) △H3=-484kJ/mol
根据盖斯定律,由①-②+![]() ③得反应CO(g)+
③得反应CO(g)+ ![]() O2(g)= CO2(g) △H=-34kJ/mol -7kJ/mol +
O2(g)= CO2(g) △H=-34kJ/mol -7kJ/mol +![]() (-484kJ/mol)=-283 kJ·mol-l;(2)根据电离常数可知草酸的酸性强于碳酸,则碳酸钠的水解程度大于草酸钠,所以0.1 mol/L Na2CO3溶液的pH大于0.1 mol/L Na2C2O4溶液的pH,草酸的酸性强于碳酸,则等浓度草酸溶液和碳酸溶液中,氢离子浓度较大的是草酸,草酸的二级电离常数均大于碳酸的,所以草酸的电离程度大于碳酸,且碳酸以第一步电离为主,因此溶液中c(H+)>c(HC2O4-)>c(C2O42-)> (HCO3-)>c (CO32-),则ac正确,bd错误;答案选AC;(3)a点pH= 3.5,查图中的交点处即为c(F-)=c(HF), Ka=
(-484kJ/mol)=-283 kJ·mol-l;(2)根据电离常数可知草酸的酸性强于碳酸,则碳酸钠的水解程度大于草酸钠,所以0.1 mol/L Na2CO3溶液的pH大于0.1 mol/L Na2C2O4溶液的pH,草酸的酸性强于碳酸,则等浓度草酸溶液和碳酸溶液中,氢离子浓度较大的是草酸,草酸的二级电离常数均大于碳酸的,所以草酸的电离程度大于碳酸,且碳酸以第一步电离为主,因此溶液中c(H+)>c(HC2O4-)>c(C2O42-)> (HCO3-)>c (CO32-),则ac正确,bd错误;答案选AC;(3)a点pH= 3.5,查图中的交点处即为c(F-)=c(HF), Ka=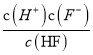 ,故Ka=c(H+),故所对应的pH即为Ka的负对数,即为10-3.45(或3.5×10-4);(3) 当pH=4.0时,溶液中的c(F-)=1.6×10-3mol/L,溶液中c(Ca2+)=2.0×l0-4mol/L,c( Ca2+)×c2(F-)= 5.l×10-10> Ksp( CaF2),有沉淀产生。
,故Ka=c(H+),故所对应的pH即为Ka的负对数,即为10-3.45(或3.5×10-4);(3) 当pH=4.0时,溶液中的c(F-)=1.6×10-3mol/L,溶液中c(Ca2+)=2.0×l0-4mol/L,c( Ca2+)×c2(F-)= 5.l×10-10> Ksp( CaF2),有沉淀产生。


科目:高中化学 来源: 题型:
【题目】H2RO3是一种二元酸,常温下用1L1mol·L-1Na2RO3溶液吸收RO2气体,溶液的pH随RO2气体的物质的量的变化如图所示。下列说法正确的是
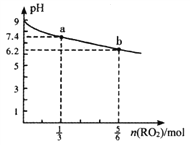
A. a点溶液中2c(Na+)=3c(RO32-)
B. 向b点溶液中加水可使溶液的pH由6.2升高到7.4
C. 常温下,NaHRO3溶液中c(HRO3-)>c(RO32-)>c(H2RO3)
D. 当吸收RO2的溶液呈中性时,c(Na+)=c(RO32-)+c(HRO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是常见的强氧化剂,广泛用于水处理系统。制取臭氧的方法很多,其中高压放电法和电解纯水法原理如图所示,下列有关说法不正确的是 ( )
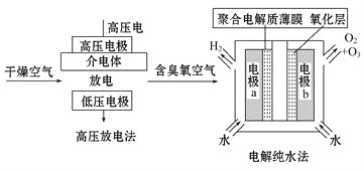
A. 高压放电法,反应的原理为3O2![]() 2O3
2O3
B. 高压放电出来的空气中,除含臭氧外还含有氮的氧化物
C. 电解纯水时,电极b周围发生的电极反应有6OH--6e-=O3↑+3H2O和4OH--4e-=O2↑+2H2O
D. 电解水时,H+由电极a经聚合电解质薄膜流向电极b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所得溶液中,其物质的量浓度为1.0 mol/L的是( )
A. 将20 g NaOH溶解在500 mL水中
B. 将22.4 L HCl气体溶于水配成1 L溶液
C. 将62.5 g胆矾(CuSO4·5H2O)溶解在适量水中,再加蒸馏水直到溶液的体积为250 mL
D. 将100 mL 10 mol/L的硫酸加入到900 mL水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)在元素周期表中M位于_____区,基态M原子的价层电子排布图为_____,第四能层s轨道上电了数目和M元素相同的元素还有_____(填元素符号)。
(2)元素Y基态原子的核外电子排布式为_______,其同周期元素中,第一电离能最大的是____(写元素符号)。元素Y的含氧酸中,酸性最强的是_____(写化学式),该酸根离子的立体构型为_______。
(3)Z与元素Y同主族,在该族中原子序数最小,Z的气态氢化物的稳定性大于Y的气态氢化物的稳定性,原因是__________,Z的气态氢化物的沸点大于Y的气态氢化物的沸点,原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用双线桥法表示反应中电子转移的方向和数目CuO+H2![]() Cu+H2O________________;该反应中,_____元素化合价升高,_____电子,发生氧化反应。_____元素化合价降低,_____电子,发生还原反应。
Cu+H2O________________;该反应中,_____元素化合价升高,_____电子,发生氧化反应。_____元素化合价降低,_____电子,发生还原反应。
(2)用双线桥法表示反应中电子转移的方向和数目2Na+Cl2![]() 2NaCl________________;该反应中,Cl元素化合价______,得到电子,发生______反应。Na元素化合价______,失去电子,发生______反应。
2NaCl________________;该反应中,Cl元素化合价______,得到电子,发生______反应。Na元素化合价______,失去电子,发生______反应。
(3)配平下列氧化还原反应方程式:
①____HNO3![]() ____H2O+____NO2↑+____O2↑;
____H2O+____NO2↑+____O2↑;
②____Cl2+____KOH=____KCl+____KClO3+____H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子一定能大量共存的是( )
A.Fe2+、OH-、NO3-、Cl-B.Ca2+ 、H+、Cl- 、HCO3-
C.Na+、Ca2+ 、NO3-、CO32-D.Mg2+、Al3+、Cl- 、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中能大量共存,加入OH-能产生沉淀的是( )
A.K+、Mg2+、SO42-、NO3-B.H+、Mg2+、CO32-、S2-
C.Na+、Ca2+、SO42-、Cl-D.MnO4、Cu2+ 、I、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂质所选用的试剂和主要操作都正确的是( )
选项 | 物质 | 杂质 | 试剂 | 主要操作 |
A | K2CO3 | KHCO3 | 无 | 加热 |
B | CuO | Al2O3 | 氨水 | 过滤 |
C | I2 | H2O | 乙醇 | 萃取 |
D | CO2 | HCl | 饱和Na2CO3溶液 | 洗气 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com