
分析 (1)根据盖斯定律:②=③-①得反应②的△H2;
(2)依据反应①+②得到反应③,所以平衡常数K3=K1×K2,依据某时刻浓度商计算和平衡常数比较判断反应进行的方向;
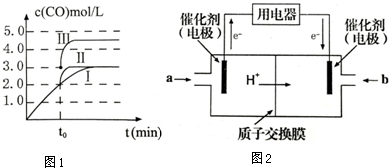
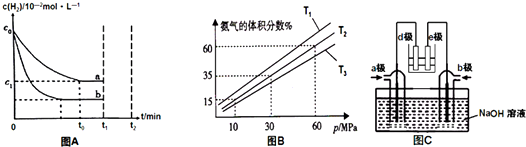
(3)图象分析曲线Ⅰ变化为曲线Ⅱ是缩短反应达到平衡的时间,最后达到相同平衡状态,体积是可变得是恒压容器,说明改变的是加入了催化剂;曲线I变为曲线III时,一氧化碳的浓度由0.3mol/L变为0.45mol/L,容器的体积由3L变为2L;
(4)根据题给装置知本题考查酸性甲醇燃料电池,根据外电路电子流向判断左侧电极为电池的负极,发生氧化反应;
(5)溶液等体积混合溶质浓度减少一半,醋酸电离平衡常数与浓度无关,结合概念计算.
解答 解:(1)已知反应①:CO(g)+2H2(g)?CH3OH(g)△H1=-90.77kJ/mol,反应②:CO2(g)+H2(g)?CO(g)+H2O(g)△H2,反应③:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H3=-49.58kJ/mol,根据盖斯定律:②=③-①得反应②的△H2=+41.19 kJ•mol-1,
故答案为:+41.19 kJ•mol-1;
(2)根据已知反应确定K1=c(CH3OH)/c(CO)c2(H2)、K2=c(CO)c(H2O)/c(CO2)c(H2)、K3=c(CH3OH) c(H2O)/c(CO2)c3(H2),则K3=K1•K2.500℃时K1、K2的值分别为2.5、1.0,则K3=K1•K2=2.5,该温度下反应③在某时刻,Q=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$=$\frac{0.3×0.15}{0.1×0.{8}^{3}}$=0.9<K3,反应正向进行,则此时V正>V逆.
故答案为:>;
(3)分析图象知t0时刻改变一个条件,曲线I变为曲线II,一氧化碳的平衡浓度没有变化而达平衡的时间缩短,改变的条件是加入催化剂;反应②为反应前后气体物质的量不变的反应,改变压强,平衡不移动,曲线I变为曲线III时,一氧化碳的浓度由0.3mol/L变为0.45mol/L,容器的体积由3L变为2L.
故答案为:加入催化剂; 2L;
(4)根据题给装置知本题考查酸性甲醇燃料电池,根据外电路电子流向判断左侧电极为电池的负极,发生氧化反应,即甲醇被氧化为二氧化碳,结合碳元素的化合价变化确定失电子数目,根据原子守恒和电荷守恒配平,电极反应式为CH3OH-6e-+H2O=CO2+6H+.
故答案为:CH3OH-6e-+H2O=CO2+6H+;
(5)通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,溶液中溶质为醋酸钡和氢氧化钡,反应平衡时,2c(Ba2+)=c(CH3COO-)=bmol/L,溶液中c(H+)=c(OH-)=10-7mol/L,溶液呈中性,醋酸电离平衡常数依据电离方程式写出K=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{b×1{0}^{-7}}{\frac{a}{2}-b}$=$\frac{2b}{a-2b}$×10-7L/mol;
故答案为:$\frac{2b}{a-2b}$×10-7L/mol.
点评 本题考查了化学平衡影响因素分析判断,平衡常数计算和影响条件的应用,难溶电解质溶液中溶度积的计算,题目综合性较大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 向品红溶液中通入气体X,品红溶液褪色,则气体X可能是Cl2 | |
| B. | CO2中含少量SO2,可将该混合气体通人足量饱和NaHCO3溶液中除去SO2: | |
| C. | 用洁净的铂丝蘸取某食盐试样,在酒精灯火焰上灼烧,火焰显黄色,说明该食盐试样中不含KIO3 | |
| D. | 相同体积、pH均为3的HA和HB两种酸的溶液分别与足量的锌充分反应,HA放出的氢气多,说明HB的酸性比HA的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
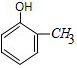 2-甲基苯酚、
2-甲基苯酚、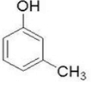 3-甲基苯酚、
3-甲基苯酚、 4-甲基苯酚.
4-甲基苯酚.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
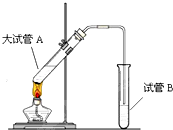 在实验室,可以用如图所示的装置制取乙酸乙酯.请回答下列问题:
在实验室,可以用如图所示的装置制取乙酸乙酯.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ②
②查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3mol | B. | 0.15mol | ||
| C. | 小于0.15mol | D. | 大于0.15mol,小于0.3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H2含碳量最高,燃烧生成的CO2最多 | |
| B. | C2H2燃烧时火焰最明亮 | |
| C. | CH4含氢量最高,燃烧生成H2O最多 | |
| D. | CH4、C2H4燃烧生成H2O质量不同,消耗O2不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com