
| A. | 氯化钠溶于水中 | B. | NH3(g)与HCl(g)反应生成NH4Cl(s) | ||
| C. | 干冰(CO2)的升华 | D. | CaCO3(s)分解为CaO(s)和CO2(g) |
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案科目:高中化学 来源: 题型:填空题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
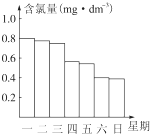 某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等.
某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某温度下,溶液中c(H+)=10xmol•L-1,c(OH-)=10ymol•L-1,x和y的关系如图所示.则该温度下,0.01mol•L-1的NaOH溶液的pH为( )
某温度下,溶液中c(H+)=10xmol•L-1,c(OH-)=10ymol•L-1,x和y的关系如图所示.则该温度下,0.01mol•L-1的NaOH溶液的pH为( )| A. | 10 | B. | 11 | C. | 13 | D. | 12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol某气体的体积为22.4L,该气体所处的状态一定是标准状况 | |
| B. | 将22.4L氯化氢气体溶解于水并配成1L溶液,所得溶液浓度为1mol•L-1 | |
| C. | 任何状况下,1molCO2和18gH2O所含的分子数和原子数都相等 | |
| D. | 20ml0.1mol/L的AlCl3溶液中的Cl-的物质的量浓度小于50mL0.2mol/L的NaCl溶液中的Cl-的物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将①、④等体积混合,混合液一定呈碱性 | |
| B. | 将②、③混合,若有pH=7,则消耗溶液的体积:②=③ | |
| C. | 水的电离程度:①<② | |
| D. | 将四份溶液稀释相同倍数后,溶液的pH:③>④,②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44g CO2含有氧原子数为NA | |
| B. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| C. | 23gNa在足量的O2中充分燃烧失去2mole-生成Na2O2 | |
| D. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com