
下列关于电解质的说法不正确的是
A.一般来说,酸、碱、盐是电解质,非金属氧化物是非电解质
B.常见弱电解质有弱酸、弱碱、水等
C.强电解质的水溶液导电能力一定强,弱电解质的水溶液导电能力一定弱
D.蔗糖、酒精都属于非电解质
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015-2016学年四川成都外国语学校高一下期末理科化学卷(解析版) 题型:选择题
短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数,且X、Y、W原子最外层电子数之和恰好等于Z元素的核电荷数,X与W的最高化合价之和为8,常见金属元素Z的一种核素的质量数为28,中子数比质子数多2。下列说法中正确的是
A.Y和W的含氧酸均为强酸
B.YW3分子中Y原子的杂化方式为sp2,分子的空间构型为平面三角形
C.由非金属元素组成的化合物YX5是一种是否存在尚待确证的化合物,假如存在,该物质与水反应必然生成气体X2,同时得到一种弱碱溶液
D.因为Z的氧化物熔点很高,不适宜于电解,故工业上常用电解Z与W的化合物的方法制取单质Z
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二下期末化学试卷(解析版) 题型:推断题
【加试题】某研究小组以烃A为主要原料,采用以下路线合成药物X和高聚物Y:
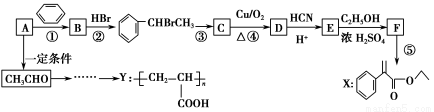
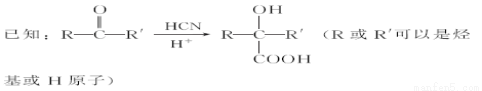
请回答下列问题:
(1)若反应①、②的原子利用率均为100%,则A的名称为________。
(2)反应③的条件是________________,反应⑤的反应类型是________________。
(3)写出反应④的化学方程式________________________________________。
(4)写出同时符合下列条件的E的所有同分异构体的结构简式:___________________。
ⅰ.属酚类化合物,且是苯的对位二取代物;ⅱ.能发生银镜反应和水解反应。
(5)以CH3CHO为原料可合成Y,请结合本题信息,设计合成路线(无机试剂及溶剂任选)。
注:合成路线的书写格式参照如下示例流程图。CH3CH2OHH2C===CH2BrH2C—CH2Br
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二下期末化学试卷(解析版) 题型:选择题
将2molA与2molB混合于2L的密闭容器中发生如下反应:2A(g)+3B(g) 2C(g)+zD(g),2s后A的转化率为50%,测得v(D)=0.25mol•L-1•s-1,下列推断不正确的是
2C(g)+zD(g),2s后A的转化率为50%,测得v(D)=0.25mol•L-1•s-1,下列推断不正确的是
A.v(C)=v(D)=0.25mol•L-1•s-1
B.C的体积分数为28.6%
C.B的转化率为25%
D.z=2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二下期末化学试卷(解析版) 题型:选择题
下列有关氯气的说法正确的是
A.氯气在自然界中既可以以化合态存在,也可以以游离态存在
B.氯气是一种黄绿色,有毒的气体
C.氯气不能溶解于水,所以可用排水法收集氯气
D.氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二下期末化学试卷(解析版) 题型:简答题
【加试题】工业制硫酸,利用催化氧化反应将SO2转化为SO3是一个关键步骤。请回答:
(1)某温度下,SO2(g)+O2(g) SO3(g) ;ΔH=-98 kJ · mol-1。开
SO3(g) ;ΔH=-98 kJ · mol-1。开 始时在100 L的密闭容器中加入4.0 mol
始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K=________ 。
SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K=________ 。
(2)一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1 mol O2,发生下列反应:2SO2(g)+O2(g) 2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是________(填字母)。
2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是________(填字母)。
A.保持温度和容器体积不变,充入2 mol SO3
B.保持温度和容器体积不变,充入2 mol N2
C.保持温度和容器体积不变,充入0.5 mol SO2和0.25 molO2
D.保持温度和容器内压强不变,充入1 mol SO3
E.升高温度
F.移动活塞压缩气体
(3)某人设想以下图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:______。

(4)下列关于2SO2(g)+O2(g) 2SO3(g)反应的图像中,
2SO3(g)反应的图像中, 一定正确的是________(填序号)。
一定正确的是________(填序号)。

(5)①某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示。当平衡状态由A变到B时,平衡常数K(A)_______ K(B)(填“>”、“<”或“=”)。
②将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如下图所示。若在第5分钟将容器的体积缩小一半后,在第8分钟达到新的平衡(此时SO3的浓度为0.25 mol·L-1)。请在下图画出此变化过程中SO3(g)浓度的变化曲线。

查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二下期末化学试卷(解析版) 题型:选择题
室温下,将1.000mol•L﹣1盐酸滴入20.00mL 1.000mol•L﹣1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是:

A.a点由水电离出的c(H+)=1.0×10﹣14mol• L﹣1
L﹣1
B.b点 :c(NH4+)+c(NH3•H2O)=
:c(NH4+)+c(NH3•H2O)= c(Cl﹣)
c(Cl﹣)
C.c点:c(Cl﹣)=c(NH4+)
D.d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二下期末化学试卷(解析版) 题型:选择题
硫元素在周期表中的位置是
A. 第二周期VIA族 B. 第三周期VIA族
C. 第二周期ⅦA族 D. 第三周期IVA族
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高一下期末化学试卷(解析版) 题型:填空题
短周期元素W、X、Y、Z是原子序数依次增大的同一周期主族元素,W、X是金属,Y、Z是非金属元素。请回答下列问题:
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为______。
(2)W与Y可形成化合物W2Y,该化合物的电子式为______________。
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为______________。
(4)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是___>____>____>____。
(5)Z的最高价氧化物为无色液体,该物质与水可发生反应。写出该反应的化学方程式:_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com