
| A. | 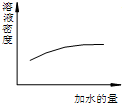 浓硫酸的稀释 浓硫酸的稀释 | |
| B. | 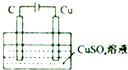 某电极上有铜产生,且溶液中铜离子浓度不变 | |
| C. |  微粒电子数 微粒电子数 | |
| D. | 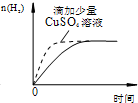 过量的盐酸和等量的锌粉反应 过量的盐酸和等量的锌粉反应 |
分析 A.浓硫酸浓度越大其密度越小;
B.电解时,阳极上氢氧根离子放电生成氧气、阴极上铜离子放电生成Cu;
C.分子、原子或基团中电子数=质子数,阳离子中电子数=质子数-电荷数,阴离子中电子数=质子数+电荷数;
D.锌和铜离子发生置换反应生成Cu,Cu、Zn和稀盐酸构成原电池,原电池加快反应速率.
解答 解:A.浓硫酸浓度越大其密度越小,所以浓硫酸密度随着溶液的稀释而减小,故A错误;
B.电解时,阳极上氢氧根离子放电生成氧气、阴极上铜离子放电生成Cu,溶液中铜离子浓度降低,故B错误;
C.分子、原子或基团中电子数=质子数,水分子、羟基中电子数分别是10、9,阳离子中电子数=质子数-电荷数,则水和氢离子中电子数是10,阴离子中电子数=质子数+电荷数,氢氧根离子中电子数是10,故C正确;
D.锌和铜离子发生置换反应生成Cu,Cu、Zn和稀盐酸构成原电池,原电池加快反应速率,锌和铜反应导致生成氢气的量减少,故D错误;
故选C.
点评 本题考查图象分析,侧重考查学生分析判断能力,涉及原电池和电解池原理、电子数的计算、溶液密度与浓度关系,注意电解池中活泼金属作阳极时金属失电子而不是电解质溶液中阴离子失电子,易错选项是D,如果将题改为“等量的稀盐酸和足量锌反应”时该图象就正确,注意仔细审题.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol•L-1的FeCl3溶液中,Fe3+离子个数小于NA | |
| B. | Al3+和S2-,NO3-和S2-两组离子在酸、碱和中性溶液中均不能大量共存 | |
| C. | Ca(HCO3)2溶液与过量NaOH溶液反应的离子方程式:Ca2++HCO3-+OH-=CaCO3↓+2H2O | |
| D. | 向10 mL 0.1 mol•L-1 CH3COONa溶液中加入5 mL 0.1 mol•L-1盐酸时,溶液中c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
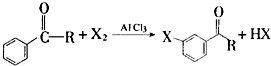


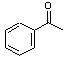 +Br2$\stackrel{AlCl_{3}}{→}$
+Br2$\stackrel{AlCl_{3}}{→}$ +HBr
+HBr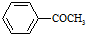 的符合以下条件的同分异构体还有4种(不包括原料本身),条件:结构中必须含有苯环和
的符合以下条件的同分异构体还有4种(不包括原料本身),条件:结构中必须含有苯环和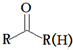 ,其中核磁共振氢谱图中共有5个吸收峰的分子的结构简式为
,其中核磁共振氢谱图中共有5个吸收峰的分子的结构简式为
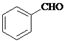 )和乙醇为原料合成苯乙酸乙酯,如图
)和乙醇为原料合成苯乙酸乙酯,如图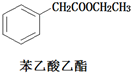 :
:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 化学式为C6H6O6 | |
| B. | 乌头酸能使酸性高锰酸钾溶液或溴水褪色 | |
| C. | 乌头酸能发生水解反应和加成反应 | |
| D. | 含l mol乌头酸的溶液最多可消耗3 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)CH3+、-CH3(甲基)、CH3-都是重要的有机反应中间体,有关它们的说法正确的是CDE.
(1)CH3+、-CH3(甲基)、CH3-都是重要的有机反应中间体,有关它们的说法正确的是CDE.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HD、H2O、NH3均为化合物 | |
| B. | CH2O2、C3H6O2、C4H8O2一定互为同系物 | |
| C. | HCOOCH3、CH3COOH、HOCH2CHO互为同分异构体 | |
| D. | SiO2、NaCl、S8、Cu均是能表示物质分子组成的分子式 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 浓氨水和浓HNO3 | B. | 浓氨水和浓盐酸 | C. | 浓氨水和浓H2SO4 | D. | 浓氨水和浓H3PO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com