
下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
A.NH4Cl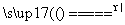 NH3↑+HCl↑
NH3↑+HCl↑
B.NH3+CO2+H2O===NH4HCO3
C.2NaOH+Cl2===NaCl+NaClO+H2O
D.2Na2O2+2CO2===2Na2CO3+O2
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
用如图所示装置进行下列实验,实验结果与预测现象不一致的是

| 选项 | 中物质 | ②中物质 | 预测①中现象 |
| A | 酚酞溶液 | 浓氨水 | 无色变红色 |
| B | 湿润红布条 | 饱和氯水 | 红布条褪色 |
| C | 淀粉KI溶液 | 浓硝酸 | 无明显变化 |
| D | 硝酸银溶液 | 浓盐酸 | 有白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下面三个数据:①7.2×10-4 ②4.6×10-4 ③4.9×10-10,分别是三种酸的电离平衡常数,若已知这些酸可发生如下反应:NaCN+HNO2===HCN+NaNO2;NaCN+HF===HCN+NaF;NaNO2+HF===HNO2+NaF。由此可判断下列叙述中,正确的是( )
A.HF的电离平衡常数是①
B.HNO2的电离平衡常数是①
C.HCN的电离平衡常数是②
D.HNO2的电离平衡常数是③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关σ键的说法错误的是( )
A.如果电子云图象是由两个s电子重叠形成的,即形成ss σ键
B.s电子与p电子可形成sp σ键
C.p电子与p电子不能形成σ键
D.HCl分子里含一个sp σ键
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实与氢键无关的是( )
A.液态氟化氢中有三聚氟化氢(HF)3分子存在
B.冰的密度比液态水的密度小
C.乙醇能与水以任意比混溶而甲醚(CH3—O—CH3)难溶于水
D.H2O比H2S稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
下列是A、B、C、D、E五种元素的某些性质:
|
| A | B | C | D | E |
| 化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.55 | 2.58 | 3.16 | 3.44 | 3.98 |
(1)元素A是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是________。
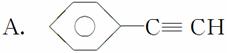
B.CH4
C.CH2===CHCH3
D.CH3CH2C≡CH
E.CH3CH3
(2)用氢键表示式写出E的氢化物的水溶液中存在的所有氢键___________________________________________。
(3)相同条件下,AD2与BD2分子在水中的溶解度较大的是________(化学式),理由是________________________。
(4)B、D形成的氢化物沸点:________更高,热稳定性________更强。(写化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.CHCl3是正四面体形
B.H2O分子中氧原子为sp2杂化,其分子几何构型为V形
C.二氧化碳中碳原子为sp杂化,为直线形分子
D.NH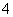 是三角锥形
是三角锥形
查看答案和解析>>
科目:高中化学 来源: 题型:
配位化学创始人维尔纳发现,将各为1 mol的CoCl3·6NH3(黄色)、CoCl3·5NH3(紫红色)、CoCl3·4NH3(绿色)、CoCl3·4NH3(紫色)四种配合物溶于水,加入足量硝酸银溶液,立即沉淀的氯化银分别为3 mol、2 mol、1 mol、和1 mol。已知上述配合物中配离子的配位数均为6。
(1)请根据实验事实用配合物的形式写出它们的化学式。
CoCl3·6NH3______________________,
CoCl3·5NH3____________________,
CoCl3·4NH3(绿色和紫色)____________。
(2)后两种物质组成相同而颜色不同的原因是它们互为同分异构体,已知绿色的配合物内界结构对称,请在下图中用元素符号标出氯原子的位置。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com