
 实验室可用如图所示装置进行多个实验探究,请回答下列问题.
实验室可用如图所示装置进行多个实验探究,请回答下列问题.分析 (1)铁和盐酸反应能够生成氢气和氯化亚铁;
(2)铁发生电化学腐蚀;
(3)A中的铁钉表面覆盖一层红色物质,应为铜,铁置换出铜.
解答 解:(1)铁和盐酸反应能够生成氢气和氯化亚铁,方程式为Fe+2HCl=FeCl2+H2↑.氯化亚铁的溶液为浅绿色,故该反应的现象是有气泡产生溶液变为浅绿色,
故答案为:Fe+2HCl=FeCl2+H2↑;有气泡产生溶液变为浅绿色;
(2)若液体A为蒸馏水则铁钉具备与氧气和水共存的条件,所以会发现铁钉在水外面的部分会生锈,故答案为:在蒸馏水与空气的接触面附近,铁钉生锈严重;
(3)若一段时间后,观察到浸没在A中的铁钉表面覆盖一层红色物质,则是铁和硫酸铜溶液发生置换反应的过程,方程式为Fe+CuSO4═Cu+FeSO4;
故答案为:Fe+CuSO4═Cu+FeSO4.
点评 本题综合考查铁的性质,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,注意铁发生电化学腐蚀的条件,难度不大.


科目:高中化学 来源: 题型:解答题
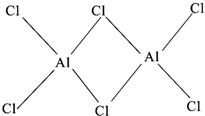 有机反应中常用镍作催化剂.某镍催化剂中含Ni 64.0%、Al 24.3%、Fe 1.4%,其余为C、H、O、N等元素.
有机反应中常用镍作催化剂.某镍催化剂中含Ni 64.0%、Al 24.3%、Fe 1.4%,其余为C、H、O、N等元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干水属于有机合成材料 | |
| B. | 干水中的水分子停止运动 | |
| C. | 干水是一种混合物 | |
| D. | 干水吸收CO2的过程只发生物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

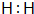 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | D | E | |
| 化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.55 | 2.58 | 3.16 | 3.44 | 3.98 |
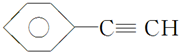 B.CH4
B.CH4查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 周期表中的副族、Ⅷ族都是金属元素 | |
| B. | 周期表中的ⅡA族都是金属元素 | |
| C. | 周期表中的非金属元素都位于短周期 | |
| D. | 周期表中的0族元素都是非金属元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com