
| A. | ①②③④⑤ | B. | ②③④⑤ | C. | ②⑤ | D. | ③④ |
科目:高中化学 来源: 题型:选择题
| A. | B的氢化物的沸点比D的氢化物要高,原因是B的非金属性强 | |
| B. | 比较A、C元素形成的常见氧化物,它们的化学键类型相同,晶体类型也相同 | |
| C. | C的最高价氧化物的水化物酸性比D的最高价氧化物的水化物酸性强 | |
| D. | 根据元素周期律,推测E在氧气中燃烧时可能生成E2O2、EO2等物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol过氧化钠和足量水充分反应,理论上转移的电子数约为2×6.02×1023 | |
| B. | 电工操作中将铝线与铜线直接相连,会导致铜线更快被氧化 | |
| C. | MnS悬浊液中滴加少量CuSO4溶液可生成CuS沉淀,则Ksp(CuS)<Ksp(MnS) | |
| D. | 0.1mol•L-1醋酸溶液pH=a,0.01mol•L-1醋酸溶液pH=b,则a+1<b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNH4Cl固体中共价键总数为5NA | |
| B. | 16gO2与O3的混合物中含有NA个氧原子 | |
| C. | 向装有催化剂的密闭容器加入3molH2和1molN2,充分反应后得2NA个氨分子 | |
| D. | 18g水(H2O)含有8NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
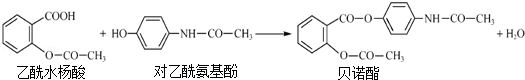
| A. | 1mol贝诺酯分子可与7molH2完全反应 | |
| B. | 可用FeCl3 溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | 贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 | |
| D. | 乙酰水杨酸和对乙酰氨基酚均可与NaHCO3 溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
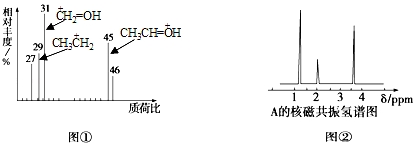
| A. | HCOOH | B. | CH3CHO | C. | CH3CH2OH | D. | CH3CH2COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
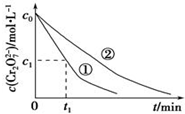 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 |
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com